19.如图所示的四个原电池装置,其中结论正确的是( )
| A. |  Mg作负极,电子流向:Mg一→稀硫酸一→A1 | |
| B. |  Al作负极,电极反应式6H2O+6e-═6OH-+3H2↑ | |
| C. |  Cu作负极,电极反应式Cu-2e-═Cu2+ | |
| D. |  Cu作正极,电极反应式:2H++2e═H2↑ |
18.下列各有机物在酸性条件下发生水解反应,生成两种不同的物质,且这两种物质的相对分子质量相等.这种有机物是( )
| A. | 甲酸甲酯 | B. | 丙酸乙酯 | C. | 蔗糖 | D. | 麦芽糖 |
16.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
12.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
0 171202 171210 171216 171220 171226 171228 171232 171238 171240 171246 171252 171256 171258 171262 171268 171270 171276 171280 171282 171286 171288 171292 171294 171296 171297 171298 171300 171301 171302 171304 171306 171310 171312 171316 171318 171322 171328 171330 171336 171340 171342 171346 171352 171358 171360 171366 171370 171372 171378 171382 171388 171396 203614
| A. | 常温常压下,33.6L氯气与27g铝充分反应,生成1molAlCl3 | |
| B. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 | |
| C. | 通常状况下,2.24LNO2和N2O4的混合气体中氮原子和氧原子数比为1:2 | |
| D. | 1L 1mol/L的Na2CO3溶液中所含阴离子数等于NA个 |
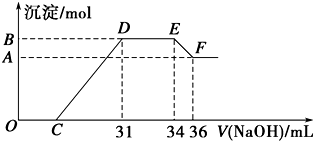
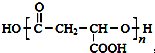 ,合成M的流程图如下:
,合成M的流程图如下: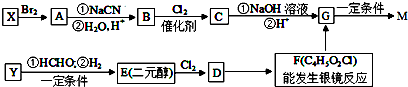
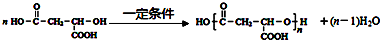
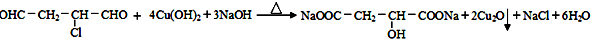
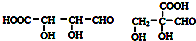 .
. A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题: ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka=4×10?12(提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)
;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka=4×10?12(提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)