1.在密闭容器中A与B反应生成C,其反应速率分别用V(A),V(B),V(C)表示.已知2V(B)=3V(A),3V(C)=2V(B),则此反应可表示为( )
| A. | 2A+3B=2C | B. | A+3B=2C | C. | 3A+B=2C | D. | A+B=C |
20.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、SO42- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl-、HCO3- |
19.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图装置①.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列有关叙述不正确的是( )


| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 | |
| C. | 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
18.NaHS是一种重要的化工原料,下列有关NaHS的离子反应方程式书写正确的是( )
| A. | NaHS在水中的电离方程式为NaHS═Na++H++S2- | |
| B. | NaHS溶液水解的离子方程式为HS-+H2O═H2S↑+OH- | |
| C. | NaHS溶液与FeSO4溶液反应的离子方程式为S2-+Fe2+═FeS↓ | |
| D. | 向NaHS溶液中滴加过量的新制氯水:HS-+Cl2═S↓+H++2Cl- |
17.下列判断正确的是( )
| A. | T℃时,KW=1.0×10-12.该温度下,PH=3的溶液中,水电离出的c(H+)=1.0×10-11 | |
| B. | 25℃时,PH=a的氨水与PH=b的盐酸等体积混合至溶液呈中性,则a+b=14 | |
| C. | 0.1mol/LNaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.05mol/LNaOH溶液等体积混合,所得溶液中,2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
16.下列四个数据是在不同条件下测出的合成氨反应N2+3H2?2NH3的速率,其中最快是( )
| A. | V(H2)═0.3 mol/(L•min) | B. | V(N2)═0.1mol/(L•min) | ||
| C. | V(NH3)═0.15mol/(L•min) | D. | V(N2)═0.2mol/(L•min) |
12.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
0 171144 171152 171158 171162 171168 171170 171174 171180 171182 171188 171194 171198 171200 171204 171210 171212 171218 171222 171224 171228 171230 171234 171236 171238 171239 171240 171242 171243 171244 171246 171248 171252 171254 171258 171260 171264 171270 171272 171278 171282 171284 171288 171294 171300 171302 171308 171312 171314 171320 171324 171330 171338 203614
| A. | 标准状况下,64gCu与足量浓硝酸反应恰好生成2NA个NO2分子 | |
| B. | 120gNaHSO4固体中含有NA个阳离子 | |
| C. | Si-O键的键能大于Si-Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
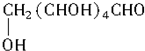 .
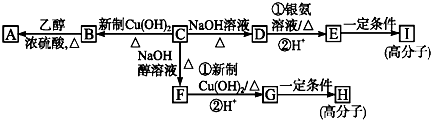
.
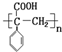 .
.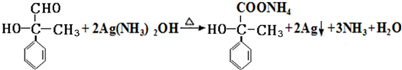 .
.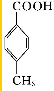 .
.