19.如图表示取1mol乙烯雌酚进行的4个实验,下列对实验数据的预测正确的是( )
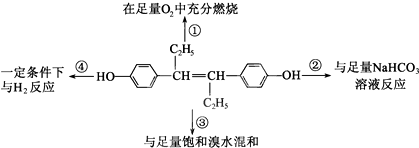

| A. | ①中生成7molH2O | B. | ②中生成2molCO2 | ||
| C. | ③最多消耗3molBr2 | D. | ④中最多消耗7molH2 |
18.对于可逆反应2SO2 (g)+O2(g)?2SO3(g)△H<0在一定温度下其平衡数为K,下列说法正确的是( )
| A. | 增大SO2的转化率K值一定增大 | B. | 减小压强K值减小 | ||
| C. | 升高温度K值增大 | D. | K值越大SO2转化率越大 |
16.标准状况下,112mL某气体的质量是0.14g,该气体可能是( )
| A. | O2 | B. | N2 | C. | H2 | D. | CO2 |
14.已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O?HCl+HClO达平衡后,要使HClO浓度增大,H+浓度减小,可加入( )
| A. | Na2CO3固体 | B. | 水 | C. | CaCO3固体 | D. | NaOH固体 |
13.下列生活常识中,说法错误的是( )
0 171098 171106 171112 171116 171122 171124 171128 171134 171136 171142 171148 171152 171154 171158 171164 171166 171172 171176 171178 171182 171184 171188 171190 171192 171193 171194 171196 171197 171198 171200 171202 171206 171208 171212 171214 171218 171224 171226 171232 171236 171238 171242 171248 171254 171256 171262 171266 171268 171274 171278 171284 171292 203614
| A. | 医疗上常用体积分数为75%的酒精作消毒剂 | |
| B. | 我国《居室空气中甲醛的卫生标准》规定,居室空气中甲醛的最高浓度为0.8mg/m3 | |
| C. | 使用加酶洗衣粉时,最好将水温控制在40~50℃ | |
| D. | 医院里给病人输液用的生理盐水浓度为0.9% |
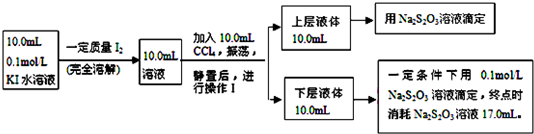
 填空
填空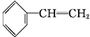 +Br2→
+Br2→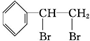 .
.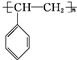 .A与氢气完全加成后的一氯代物共有6种.
.A与氢气完全加成后的一氯代物共有6种.