题目内容
1.已知:I2能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-I3-.通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数.
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).
(1)上述滴定时,可采用淀粉做指示剂,滴定终点的现象是溶液由蓝色变为无色,且30秒内不再变色(或不恢复原来颜色).
(2)下列对该同学设计方案的分析,正确的是C(填字母).
A.方案可行,能准确测定溶液中的c(I2)
B.不可行,因为I-能与Na2S2O3发生反应
C.不可行,只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
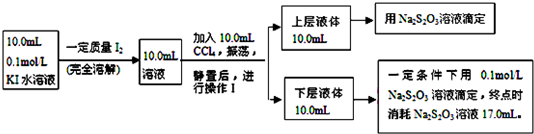
已知:①I-和I3-不溶于CCl4;②一定温度下,碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即$\frac{c[{I}_{2}(CC{l}_{4})]}{c[{I}_{2}({H}_{2}O)]}$是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85,回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是分液漏斗(填名称).
(4)下层液体中碘单质的物质的量浓度是0.085mol/L.
(5)实验测得上层溶液中c(I3-)=0.049mol•L-1,结合上述有关数据,计算室温条件下反应I2+I-I3-的平衡常数K=961(用具体数据列出计算式即可).
分析 (1)依据滴定实验和试剂选择分析判断,反应原理为,I2+2Na2S2O3=2NaI+Na2S4O6 ,指示剂选择淀粉,滴入最后一滴溶液由蓝色变化为无色,半分钟不变化证明反应达到终点;
(2)依据碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-?I3-,分析判断选项;
(3)操作Ⅰ是分液操作,用到的玻璃仪器以及分离操作装置和步骤回答分析;
(4)由硫代硫酸钠滴定碘单质的定量关系计算物质的量得到浓度;
(5)依据分配系数计算水溶液中碘单质浓度,根据反应计算水溶液中碘离子的浓度,结合平衡常数概念计算分析.
解答 解:(1)取V1 mL平衡混合溶液,用c mol•L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),指示剂选择淀粉,滴入最后一滴溶液由蓝色变化为无色,半分钟不变化证明反应达到终点,
故答案为:淀粉;溶液由蓝色变为无色,且30秒内不再变色(或不恢复原来颜色);
(2)碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-?I3-;
A.方案不可行.依据操作的化学平衡分析可知,测定的是碘单质和I3-的含量,不能准确测定溶液中的c(I2),故A错误;
B.不可行.因为I-不能与Na2S2O3发生反应,是碘单质和Na2S2O3发生反应,故B错误;
C.不可行.依据操作的平衡可知,实验只能测得溶液中c(I2)与c(I3-)之和,不能测定离子浓度,故C正确;
故答案为:C;
(3)步骤Ⅰ是分液操作,需要用到的玻璃容器,除烧杯、玻璃棒外,还有分液漏斗,故答案为:分液漏斗;
(4)依据化学反应可知设碘单质物质的量为x;
I2+2Na2S2O3=2NaI+Na2S4O6,
1 2
x 0.1mol/L×0.017L
x=0.00085mol
浓度=$\frac{0.00085mol}{0.010L}$=0.085mol/L;
故答案为:0.085mol/L;
(5)依据$\frac{c[{I}_{2}(CC{l}_{4})]}{c[{I}_{2}({H}_{2}O)]}$=85,计算得到水溶液中碘单质的浓度c(I2)=0.001mol/L;10ml溶液中c(I3-)=0.049mol•L-1,物质的量0.00049mol,所以反应的碘离子物质的量为0.00049mol,平衡状态碘离子物质的量=0.1mol/L×0.01L=0.001mol-0.00049mol=0.00051mol,I2+I-?I3-,则浓度c(I-)=0.051mol/L,平衡常数K=$\frac{c(I{\;}_{3}{\;}^{-})}{c(I{\;}^{-})c(I{\;}_{2})}$=$\frac{0.049mol/L}{0.001mol/L×0.051mol/L}$=961,
故答案为:961.
点评 本题考查了滴定实验分析判断,实验数据的计算分析应用,应用信息是解题关键,题目难度中等.

 高中必刷题系列答案
高中必刷题系列答案| A. | C5H10 | B. | C5H12O | C. | C5H11Br | D. | C5H12 |
| A. | 某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该溶液中一定含有CO32- | |
| B. | 除去HNO3溶液中的少量H2SO4,可加适量BaCl2溶液 | |
| C. | 利用焰色反应可以将NaCl和KCl两种无色溶液鉴别出来 | |
| D. | 某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
| A. | O2 | B. | N2 | C. | H2 | D. | CO2 |
| A. | 中科院广州化学所在利用二氧化碳制取可降解塑料的技术方面处于世界领先水平,该技术的成功应用将有效改善以二氧化碳为主的温室气体引发的“厄尔尼诺”、“拉尼娜”等全球气候异常现象 | |
| B. | 许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理,达到消除“白色污染”的目的 | |
| C. | 山东单县采用以杂草、秸秆等为原料的生物质发电,有效地减少了二氧化硫的排放 | |
| D. | 汽油中掺入酒精使用,可以降低对环境的污染和节约能源 |
| 选 项 | 操作及现象 | 溶 液 |
| A | 加入NaOH,溶液产生蓝色沉淀.再加入葡萄糖,加热,产生红色沉淀. | CuSO4溶液 |
| B | 加入NaOH,溶液产生白色沉淀.再通入CO2,白色沉淀消失. | Ca(HCO3)2溶液 |
| C | 加入NaOH,溶液紫色褪去.再加入盐酸,振荡,溶液又变成紫色. | I2的CCl4溶液 |
| D | 加入NaOH,溶液产生白色沉淀,有刺激性气味气体产生.继续加入 NaOH,沉淀消失. | KAl(SO4)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
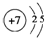 ,C元素在周期表中的位置第三周期ⅥA族.
,C元素在周期表中的位置第三周期ⅥA族. 或
或