题目内容
17.将250mL质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到600mL,求稀释后溶液中硫酸的物质的量浓度?(保留小数点后两位数字)分析 根据c=$\frac{1000ρω}{M}$计算出质量分数为98%,密度为1.84g/cm3的浓硫酸的物质的量浓度,再根据稀释过程中溶质的物质的量不变计算出稀释后溶液中硫酸的物质的量浓度.
解答 解:质量分数为98%,密度为1.84g/cm3的浓硫酸的浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
将该浓硫酸稀释到600mL,稀释过程中硫酸的物质的量不变,
则稀释后的溶液中硫酸的浓度为:$\frac{18.4mol/L×0.25L}{0.6L}$=7.67mol/L,
答:稀释后溶液中硫酸的物质的量浓度为7.67mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量浓度与溶质质量分数的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列4组原子序数的元素,彼此间能形成共价键的是( )
| A. | 8和11 | B. | 8和13 | C. | 6和8 | D. | 12和9 |
12.某同学身体不适,出现吐酸水,恶心,胃痛等症状,若你是医生,应该建议他服用下列哪种药品( )
| A. | 阿司匹林 | B. | 阿莫西林 | C. | 感冒清 | D. | 胃得乐 |
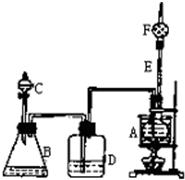 如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:
如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答: