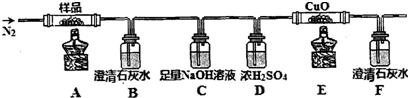
10.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.某工厂以孔雀石为主要原料制备CuSO4•5H2O及纳米材料G,主要步骤如下:
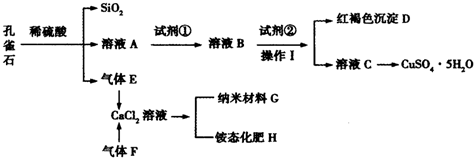
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+沉淀完全.Fe3+、Fe2+、Cu2+开始沉淀及完全沉淀的pH分别如下:
请回答下列问题:
(1)孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑.
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+.要检验其中的Fe2+应选择下列试剂中的a(填序号).
a.KMnO4 b.NaOH C.H2O2 d.KSCN
(3)试剂①是一种氧化剂,加入该氧化剂的作用是将溶液中的Fe2+氧化为Fe3+(以便在Cu(OH)2沉淀之前,通过调节溶液pH使Fe(OH)3沉淀完全);
(4)向溶液B中加入试剂②的化学式为CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3.
(5)气体E和气体F应该先通入CaCl2溶液中的是NH3(填化学式).写出制备G和H的化学反应方程式2NH3+CO2+CaCl2+H2O═CaCO3↓+2NH4Cl.
(6)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为0.0960mol/L.

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+沉淀完全.Fe3+、Fe2+、Cu2+开始沉淀及完全沉淀的pH分别如下:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
(1)孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑.
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+.要检验其中的Fe2+应选择下列试剂中的a(填序号).
a.KMnO4 b.NaOH C.H2O2 d.KSCN
(3)试剂①是一种氧化剂,加入该氧化剂的作用是将溶液中的Fe2+氧化为Fe3+(以便在Cu(OH)2沉淀之前,通过调节溶液pH使Fe(OH)3沉淀完全);
(4)向溶液B中加入试剂②的化学式为CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3.
(5)气体E和气体F应该先通入CaCl2溶液中的是NH3(填化学式).写出制备G和H的化学反应方程式2NH3+CO2+CaCl2+H2O═CaCO3↓+2NH4Cl.
(6)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-还原为Mn2+,则该反应的离子方程式为MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为0.0960mol/L.
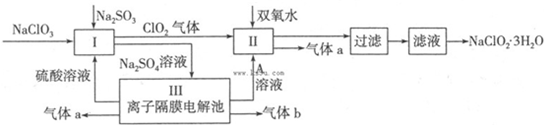
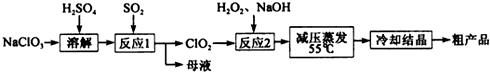
9.在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用.下图是生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4×10-28
(1)反应I中发生反应的离子方程式为SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是bdc(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为pH(Na2S)>pH(NaHCO3)>pH(NaF)>pH(NaClO2) (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为:后者大(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时体系中的S2-的浓度为6.3×10-13mol/L.
(4)Ⅲ装置中生成气体a的电极反应式2H2O-4e-=O2↑+4H+,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为0.2mol.

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4×10-28
(1)反应I中发生反应的离子方程式为SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是bdc(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时体系中的S2-的浓度为6.3×10-13mol/L.
(4)Ⅲ装置中生成气体a的电极反应式2H2O-4e-=O2↑+4H+,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为0.2mol.
5.氯化亚铜(CuCI)是有机合成工业中应用较广泛的催化剂,微溶于水,不溶于乙醇.工业上以废旧铜为原料生产氯化亚铜的流程如下:
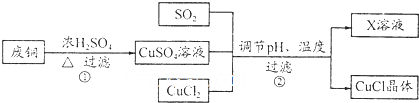
(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
(3)析出的CuCl晶体不用水而用乙醇洗涤的目的是CuCl不溶于乙醇,微溶于水,可减少晶体损失,且乙醇易挥发,利于干燥.
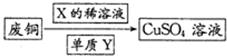
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).
方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).

(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).

方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).
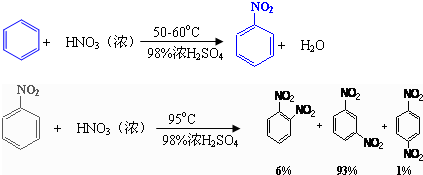
4. 硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:
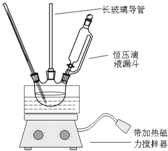
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与浓硝酸18mL配制混和酸,加入漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
(2)可能用到的有关数据列表如下
请回答下列问题:
(1)配置混酸应先在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏.
0 171085 171093 171099 171103 171109 171111 171115 171121 171123 171129 171135 171139 171141 171145 171151 171153 171159 171163 171165 171169 171171 171175 171177 171179 171180 171181 171183 171184 171185 171187 171189 171193 171195 171199 171201 171205 171211 171213 171219 171223 171225 171229 171235 171241 171243 171249 171253 171255 171261 171265 171271 171279 203614
 硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体制备,还可做有机溶剂.制备硝基苯的过程如下:①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与浓硝酸18mL配制混和酸,加入漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)

(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | / | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | / | 338 | 1.84 | 易溶于水 |
(1)配置混酸应先在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏.





 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.