9.向100mL NaOH溶液中通入标准状况下的CO2 1.12L后,将溶液小心蒸干后得到不含结晶水的固体5.08g,则下列说法中正确的是( )
| A. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3 | |
| B. | 原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3 | |
| C. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH | |
| D. | 原NaOH溶液的浓度是0.90mol/L,所得固体是Na2CO3和NaHCO3 |
7.下列说法正确的是( )
| A. | 1mol H2SO4的质量就是1个H2SO4分子的质量的98倍 | |
| B. | 水的摩尔质量是18g | |
| C. | 1mol任何物质都含有6.02×1023个原子 | |
| D. | 24g O2分子与24g O3分子所含的氧原子数相等 |
3.碗烯(D)的一种合成方法及比例模型如图所示:
下列说法正确的是( )
0 171045 171053 171059 171063 171069 171071 171075 171081 171083 171089 171095 171099 171101 171105 171111 171113 171119 171123 171125 171129 171131 171135 171137 171139 171140 171141 171143 171144 171145 171147 171149 171153 171155 171159 171161 171165 171171 171173 171179 171183 171185 171189 171195 171201 171203 171209 171213 171215 171221 171225 171231 171239 203614

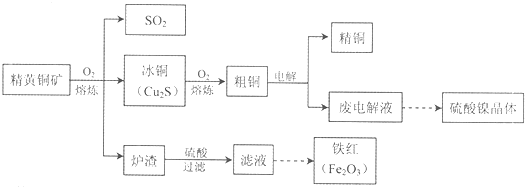
下列说法正确的是( )
| A. | 有机物A属于醛类 | B. | 有机物A与B属于同系物 | ||
| C. | 有机物C能与H2发生加成反应 | D. | 有机物D的一氯代物有2种 |