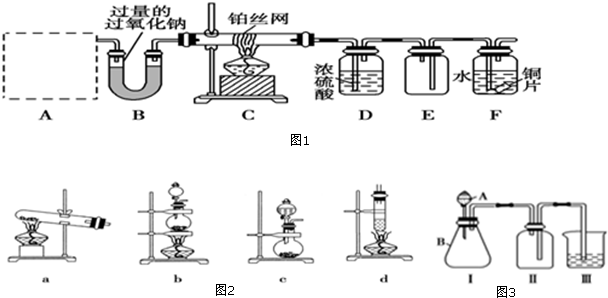
14.室温下,一气态烃与过量氧气混合完全燃烧,恢复到室温,使燃烧产物通过浓硫酸,体积比反应前减少50mL,再通过NaOH溶液,体积又减少了40mL,原烃的分子式是( )
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C3H8 |
13.诺贝尔化学奖曾授予具有埃及和美国双重国籍的科学家艾哈迈德•泽维尔,以表彰他使“运用激光技术观测化学反应时原子的运动”成为可能.艾哈迈德•泽维尔证实了光可诱发下列反应:这一事实可用于解释人眼的夜视功能和叶绿素在光合作用中极高的光能利用率,以下叙述中正确的是( )

| A. | a、b是同一种物质 | B. | a、b的分子式都是C14H14 | ||
| C. | 上述变化是化学变化 | D. | a、b都是苯的同系物 |
12.下列有机物的命名正确的是( )
| A. | 2-乙基丁烷 | B. | CH3- -CH3 1,4-二甲苯 -CH3 1,4-二甲苯 | ||
| C. | 3-甲基-2-丁烯 | D. | 3,3-二甲基丁烷. |
11.由一种阳离子与两种酸根离子组成的盐称为混盐.根据你已有的知识,分析下列不属于混盐的是( )
| A. | Na4S2O3 | B. | CaOCl2 | C. | KAl(SO4)2 | D. | Ca(NO3)Cl |
10.贮满干燥的某种气体的试管倒置于盛水的水槽中,轻轻振荡,水可以充满试管.该气体不可能是( )
| A. | HCl | B. | NO2 | C. | SO2 | D. | NH3 |
9.下列有关化学用语表示正确的是( )
| A. | Al3+的结构示意图: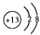 | B. | 水的电子式: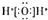 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 含有7个中子的碳原子:${\;}_{6}^{7}$C |
7.X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如表:
(1)Z位于元素周期表第三周期第IA族,其原子有11个电子.
(2)X单质的氧化性比Y单质的氧化性小(填“大”或“小”);X 最高价氧化物的电子式为: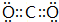 .
.
(3)写出含Z,Y两种元素的淡黄色化合物与XY2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(4)与Z位于同周期且半径最小的金属元素的最高价氧化物的水化物能与Z的最高价氧化物的水化物反应,该反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y的原子最外层电子数为层数的3倍 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X单质的氧化性比Y单质的氧化性小(填“大”或“小”);X 最高价氧化物的电子式为:
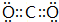 .
.(3)写出含Z,Y两种元素的淡黄色化合物与XY2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(4)与Z位于同周期且半径最小的金属元素的最高价氧化物的水化物能与Z的最高价氧化物的水化物反应,该反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
6.对达到平衡状态的下列各可逆反应,加压和降温都能使平衡逆向移动的是( )
| A. | 2NO2(g)═2NO(g)+O2(g)△H>0 | B. | 2 CO(g)═C(s)+CO2(g)△H>0 | ||
| C. | N2(g)+3H2(g)═2NH3(g)△H<0 | D. | 2O3(g)═3O2(g)△H<0 |
5.某有机物Z具有广泛的抗菌作用,其生成机理可由X与Y相互作用:下列有关叙述中正确的是( )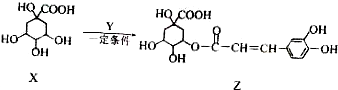
0 170952 170960 170966 170970 170976 170978 170982 170988 170990 170996 171002 171006 171008 171012 171018 171020 171026 171030 171032 171036 171038 171042 171044 171046 171047 171048 171050 171051 171052 171054 171056 171060 171062 171066 171068 171072 171078 171080 171086 171090 171092 171096 171102 171108 171110 171116 171120 171122 171128 171132 171138 171146 203614

| A. | Z结构中有4个手性碳原子 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1molZ余足量NaOH溶液反应,最多消耗8molNaOH | |
| D. | 1molZ与浓溴水反应最多消耗3molBr2 |