题目内容
8.某兴趣小组为探究氮的化合物的性质,设计了如图1所示实验装置,A为气体发生装置.按图1连接好各仪器,检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通过后面装置.片刻后可观察到F中铜片慢慢溶解.请回答下列问题(A中所用试剂,从下列固体物质中选取①NH4HCO3②NH4Cl③Ca(OH)2)(1)A制备气体相对应的装置可以是图2中的a(填字母).
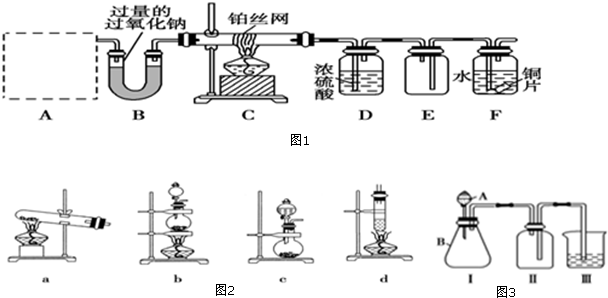
(2)写出题干装置C中发生反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,C处加热片刻后撤去酒精灯,铂丝仍保持红热,原因是反应放热,停止加热后放出的热量能维持反应继续进行.
(3)铜片完全溶解后,发现F装置中溶液呈绿色,加水稀释后呈蓝色,有同学得出两种结论:
①浓Cu(NO3)2溶液呈绿色,稀Cu(NO3)2溶液呈蓝色;
②Cu(NO3)2溶液呈蓝色,呈绿色是由于溶液溶解过量的NO2,试设计实验验证哪一种结论正确
(4)该兴趣小组同学共同设计了如图3所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题:
①甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO,理由是O2密度比空气大,应用向上排空气法收集,NO易与空气中O2反应,不能用排空法收集.
②乙同学认为:利用装置Ⅱ作简易改进(不改变仪器装置),可收集NO、O2,改进的方法是可在Ⅱ装置中加入水,用排水法收集.
分析 (1)根据加热固体的发生装置来选择;
(2)在C中发生氨的催化氧化反应,反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,反应放热,停止加热后放出的热量能维持反应继续进行;
(3)可在稀释后的硝酸铜溶液中再加入适量硝酸铜固体,如溶液仍为蓝色,则②结论正确;否则①正确;
(4)①O2密度比空气大,应用向上排空气法收集,NO易与空气中O2反应,不能用排空法收集;
②由于NO、O2都不溶于水,可在Ⅱ装置中加入水,用排水法收集.
解答 解:(1)加热NH4HCO3固体或使用NH4Cl和Ca(OH)2均可在a装置中进行,故答案为:a;
(2)在C中发生氨的催化氧化反应,反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,反应放热,停止加热后放出的热量能维持反应继续进行,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;反应放热,停止加热后放出的热量能维持反应继续进行;
(3)可在稀释后的硝酸铜溶液中再加入适量硝酸铜固体,如溶液仍为蓝色,则②结论正确;否则①正确,故答案为:可在稀释后的硝酸铜溶液中再加入适量硝酸铜固体,如溶液仍为蓝色,则②结论正确;否则①正确;
(4)①O2密度比空气大,应用向上排空气法收集,NO易与空气中O2反应,不能用排空法收集,故答案为:O2密度比空气大,应用向上排空气法收集,NO易与空气中O2反应,不能用排空法收集;
②由于NO、O2都不溶于水,可在Ⅱ装置中加入水,用排水法收集,故答案为:可在Ⅱ装置中加入水,用排水法收集.
点评 本题主要考查了气体的制备,化学方程式的书写,实验设计,实验的改进等,难度不大,关键是清楚实验的目的与原理.

| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 用重结晶法分离碳酸钠和碳酸氢钠两种固体 | |
| C. | 配置0.1000 mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 酒精灯不慎着火,应立即吹熄 | |
| C. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| D. | 氢氟酸或浓硝酸存放在带橡胶塞的棕色玻璃瓶中 |
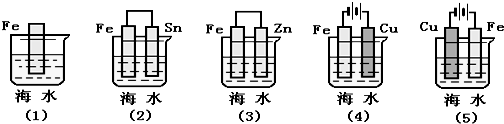
| A. | (2)(3)(4)(5)(1) | B. | (4)(3)(2)(5)(1) | C. | (5)(2)(1)(3)(4) | D. | (5)(3)(1)(2)(4) |

| A. | a、b是同一种物质 | B. | a、b的分子式都是C14H14 | ||
| C. | 上述变化是化学变化 | D. | a、b都是苯的同系物 |
| A. | 盐酸 | B. | 漂白粉 | C. | 氢氧化钠 | D. | 食盐 |
| A. | 乙二醇和丙三醇互为同系物 | |
| B. | 分子式为C7H80且属于酚类物质的同分异构体有4种 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼 | |
| D. | 乙酸乙酯中少量乙酸杂质可加饱和Na2C03溶液后经分液除去 |
 .
. 大气压强对许多物理实验和化学实验有着重要影响.
大气压强对许多物理实验和化学实验有着重要影响.