题目内容
7.X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如表:| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y的原子最外层电子数为层数的3倍 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X单质的氧化性比Y单质的氧化性小(填“大”或“小”);X 最高价氧化物的电子式为:
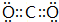 .
.(3)写出含Z,Y两种元素的淡黄色化合物与XY2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(4)与Z位于同周期且半径最小的金属元素的最高价氧化物的水化物能与Z的最高价氧化物的水化物反应,该反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
分析 X的基态原子L层电子数是K层电子数的2倍,则X为C元素;Y的原子最外层电子数为层数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;Z存在质量数为23,中子数为12的核素,则其质子数为23-12=11,则Z为Na;W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe,据此解答.
解答 解:X的基态原子L层电子数是K层电子数的2倍,则X为C元素;Y的原子最外层电子数为层数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;Z存在质量数为23,中子数为12的核素,则其质子数为23-12=11,则Z为Na;W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe.
(1)Z为Na,位于第三周期IA族,其原子核外有11个电子,故答案为:三、IA;11;
(2)由于非金属性C<O,故碳的氧化性比氧气的氧化性小,X 最高价氧化物为CO2,电子式为: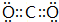 ,故答案为:小;
,故答案为:小;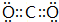 ;
;
(2)含Na、O两种元素的淡黄色化合物为Na2O2,XY2为CO2,二者反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)与Z位于同周期且半径最小的金属元素为Al,其最高价氧化物的水化物为Al(OH)3,Z的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与水,该反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 遇Fe(CN)63-生成特征蓝色沉淀的溶液:Ca2+、Clˉ、ClOˉ、Fe3+ | |
| B. | 遇石蕊变红的溶液:Na+、NH4+、NO3ˉ、K+ | |
| C. | 通有足量NO2的溶液:K+、Na+、SO32ˉ、AlO2ˉ | |
| D. | 与铝反应产生大量氢气的溶液:Ba2+、HCO3ˉ、Iˉ、Fe2+ |
15.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.现给出化学键的键能(见表):
请计算H2(g)+Cl2(g)═2HCl(g)的反应热( )
| 化学键 | H-H | Cl-Cl | Cl-H |
| 键能/(kJ•mol-1) | 436 | 243 | 431 |
| A. | 862 kJ•mol-1 | B. | 679 kJ•mol-1 | C. | 183 kJ•mol-1 | D. | -183 kJ•mol-1 |
2.为完成相应实验,实验器材(规格和数量不限)足够的一项是( )
| 相应实验 | 实验器材(省略夹持装置) | |
| A | 氯化钠溶液的浓缩结晶 | 烧杯、玻璃棒、酒精灯 |
| B | 用盐酸除去硫酸钡中的少量碳酸铜 | 烧杯、漏斗、胶头滴管、滤纸 |
| C | 用浓硫酸配制0.5mol•L-1的溶液 | 烧杯、玻璃棒、胶头滴管、容量瓶 |
| D | 用溴水和CCl4除去NaBr溶液中的少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| A. | A | B. | B | C. | C | D. | D |
12.下列有机物的命名正确的是( )
| A. | 2-乙基丁烷 | B. | CH3- -CH3 1,4-二甲苯 -CH3 1,4-二甲苯 | ||
| C. | 3-甲基-2-丁烯 | D. | 3,3-二甲基丁烷. |
19.下列物质属于芳香烃,但不是苯的同系物的有( )
①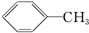 ②
② ③
③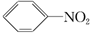 ④
④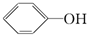 ⑤
⑤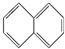 ⑥
⑥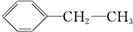
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥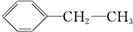
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
16.香兰素是一种重要香料,其结构如图所示.下列有关香兰素的叙述不正确的是( )


| A. | 香兰素的化学式为C8H8O3 | |
| B. | 能与Na2CO3和NaOH溶液反应 | |
| C. | 1 mol香兰素只能与含1 mol Br2的溴水反应 | |
| D. | 能使酸性高锰酸钾溶液褪色的官能团有羟基和醛基 |