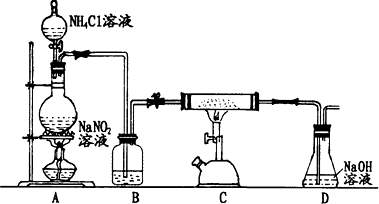
题目内容
11.由一种阳离子与两种酸根离子组成的盐称为混盐.根据你已有的知识,分析下列不属于混盐的是( )| A. | Na4S2O3 | B. | CaOCl2 | C. | KAl(SO4)2 | D. | Ca(NO3)Cl |
分析 根据由一种阳离子与两种酸根离子组成的盐称为混盐,结合物质的组成解题.
解答 解:A.Na4S2O3是由Na2S与Na2SO3组成的,故A正确;
B.混盐CaOCl2是由CaCl2与Ca(ClO)2组成的,故B正确;
C.KAl(SO4)2是由两种阳离子与一种酸根离子组成的盐,属于复盐,故C错误;
D.Ca(NO3)Cl是由Ca(NO3)2与CaCl2组成的,故D正确.
故选C.
点评 本题考查考查物质的组成,是中等难度的试题,试题综合性强,侧重对学生答题能力的培养和训练,考查学生对已知信息的提炼、归纳、总结和应用的能力,有利于培养学生的创新思维能力和应试能力.

练习册系列答案
相关题目
1.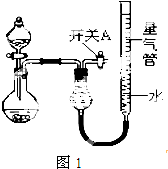 某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口塞子,旋开下面的开关,慢慢滴加;
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应;生成NO2溶于水
(3)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.浓NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
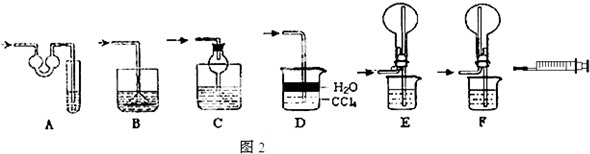
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,不能防止倒吸的是图2中的BE.
(4)写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)实验Ⅲ获得如表数据(气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
根据表中数据,可计算出镁铝合金中铝的质量分数为27%.
 某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应;生成NO2溶于水
(3)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.浓NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,不能防止倒吸的是图2中的BE.

(4)写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)实验Ⅲ获得如表数据(气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
19.将过量SO2通入下列溶液中,能出现白色沉淀的是( )
①Ca(OH)2、②BaCl2、③Na2CO3、④Na2SiO3、⑤Ba(NO3)2、⑥苯酚钠.
①Ca(OH)2、②BaCl2、③Na2CO3、④Na2SiO3、⑤Ba(NO3)2、⑥苯酚钠.
| A. | ①②④ | B. | ②③⑥ | C. | ④⑤⑥ | D. | ③⑤⑥ |
6.对达到平衡状态的下列各可逆反应,加压和降温都能使平衡逆向移动的是( )
| A. | 2NO2(g)═2NO(g)+O2(g)△H>0 | B. | 2 CO(g)═C(s)+CO2(g)△H>0 | ||
| C. | N2(g)+3H2(g)═2NH3(g)△H<0 | D. | 2O3(g)═3O2(g)△H<0 |
16.如表是元素周期表的一部分,针对表中的①~⑦种元素,填写下列空白:
(1)③和⑧的氢化物沸点高的是HF(填化学式),原因是HF分子之间存在氢键,HCl分子之间为范德华力,氢键比范德华力更强.
(2)第三周期的元素形成的单原子离子半径最大的是P3-(填化学式).
(3)①和②按质量比3:8形成的化合物A的电子式为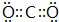 ,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)用电子式表示元素④与⑦的化合物的形成过程: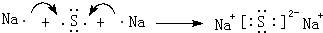 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)第三周期的元素形成的单原子离子半径最大的是P3-(填化学式).
(3)①和②按质量比3:8形成的化合物A的电子式为
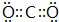 ,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,将过量A通入由②和⑤形成的阴离子的盐溶液的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.(4)用电子式表示元素④与⑦的化合物的形成过程:
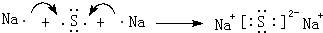 .
.
3.下列有关叙述正确的是( )
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 在电子云示意图中,小黑点密集表示电子在核外空间单位体积内电子出现的机会多 | |
| C. | 强电解质溶液一定比弱电解质溶液的导电能力强 | |
| D. | 常用原子光谱进行有机物相对分子质量的测定 |
1.开发新材料是现代科技发展的方向,下列有关材料的说法不正确的是( )
| A. | 高温结构陶瓷是新型无机非金属材料 | |
| B. | 钢是用量最大、用途最广的合金,分为碳素钢和合金钢 | |
| C. | 硅芯片是各种计算机、微电子产品的核心材料 | |
| D. | 单晶硅常用于制造光导纤维 |