9.下列推断正确的是( )
| A. | SiO2 是酸性氧化物,不溶于水,也不能与任何酸发生反应 | |
| B. | Na2O、Na2O2组成元素虽然相同,但与H2O、CO2等反应的产物不完全相同 | |
| C. | CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在 | |
| D. | 浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体 |
8.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 工业上用石灰对煤燃烧后形成的烟气进行脱硫,并能回收得到石膏 | |
| C. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| D. | 电解MgCl2溶液,可制得金属镁 |
3.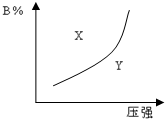 mA(g)+nB(g)?pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图中实线所示,有关叙述正确的是( )
mA(g)+nB(g)?pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图中实线所示,有关叙述正确的是( )
 mA(g)+nB(g)?pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图中实线所示,有关叙述正确的是( )
mA(g)+nB(g)?pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图中实线所示,有关叙述正确的是( )| A. | m+n>p | B. | x点的速率关系为v正>v逆 | ||
| C. | n>p | D. | x点比y点混合物反应速率快 |
2.下列表达方式正确的是( )
| A. | 氟化氢的电子式: | B. | HClO的结构式:H-Cl-O | ||
| C. | 甲基的电子式 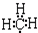 | D. | 基态氧原子L层电子排布图: |
20.下列四种溶液中:①pH值为0的盐酸;②0.1mol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH为11的氢氧化钠溶液.由水电离生成的c(H+)之比依次为( )
0 170908 170916 170922 170926 170932 170934 170938 170944 170946 170952 170958 170962 170964 170968 170974 170976 170982 170986 170988 170992 170994 170998 171000 171002 171003 171004 171006 171007 171008 171010 171012 171016 171018 171022 171024 171028 171034 171036 171042 171046 171048 171052 171058 171064 171066 171072 171076 171078 171084 171088 171094 171102 203614
| A. | 0:1:12:11 | B. | 14:13:12:11 | C. | 14:13:2:3 | D. | 1:10:100:1000 |
 铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
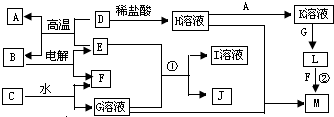
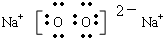 ,C物质中所含化学键类型离子键、非极性共价键.
,C物质中所含化学键类型离子键、非极性共价键.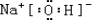 ;w属于非极性 (填“极性”或“非极性)分子;
;w属于非极性 (填“极性”或“非极性)分子;