题目内容
20.下列四种溶液中:①pH值为0的盐酸;②0.1mol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH为11的氢氧化钠溶液.由水电离生成的c(H+)之比依次为( )| A. | 0:1:12:11 | B. | 14:13:12:11 | C. | 14:13:2:3 | D. | 1:10:100:1000 |
分析 电离平衡为H2O?H++OH-,在水中加入酸或者碱溶液,导致溶液中氢离子或者氢氧根离子浓度增大,抑制了水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,结合Kw=c(H+)•c(OH-)进行计算.
解答 解:酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的,
①pH=0的盐酸,溶液中氢离子浓度为1mol/L,水电离的氢氧根离子为1×10-14mol/L;
②0.1mol/L盐酸,溶液中氢离子浓度为0.1mol/L,水电离的氢氧根离子为1×10-13mol/L;
③0.01mol/L的NaOH 溶液,溶液中氢离子浓度为1×10-12mol/L;
④pH=11的NaOH 溶液,溶液中氢离子浓度为1×10-11mol/L;
所以由水电离产生的c(H+)之比①:②:③:④=1×10-14mol/L:1×10-13mol/L:1×10-12mol/L:1×10-11mol/L=1:10:100:1000,
故选D.
点评 本题考查了溶液pH的计算、水的电离及其影响,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握水的电离程度大小的判断方法,试题充分培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
18.下列图示的化学实验操作中,正确的是( )
| A. | 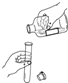 倾倒液体 | B. |  取粉末状固体药品 | ||
| C. | 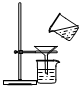 过滤 | D. |  浓硫酸的稀释 |
8.下列关于化学键的说法中正确的是( )
| A. | 化学键是一种静电引力 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 只要有旧健的断裂就一定是化学反应 | |
| D. | 氢键是一种化学键 |
9.某溶液中,除水电离出的H+、OH-之外仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种,这4种离子的物质的量均为0.1mol.若向该溶液中加入足量稀硫酸,无沉淀生成但有无色气泡产生.下列说法错误的是( )
| A. | 该溶液中一定不含Ba2+ | |
| B. | 该溶液中一定含Na+ | |
| C. | 无色气体在标准状况下的体积约为2.24L | |
| D. | 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 |
10.下列说法正确的是( )
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | 二氧化碳 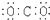 |
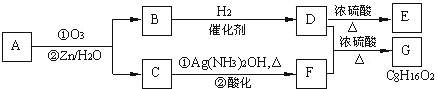
 某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.
某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.
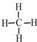 .乙烯的电子式是
.乙烯的电子式是 .将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5
.将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5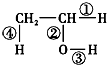 在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.
在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.