7. 燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
Ⅰ.CH4还原法:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=bkJ•mol-1甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=0.5(a+b)kJ/mol.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
(1)在0~10min内化学反应速率υNO2(T1):υNO2(T2)为3:4;
(2)T1< T2(填<,=,>); a<0(填<,=,>)
(3)在T1时,0~10min内内NO2的转化率是50%;欲提高NO2的转化率同时加快反应速率,可采取的措施有B
A.缩小容器体积 B.增大CH4浓度 C.降低温度 D.加入催化剂
Ⅱ. NOx也可以用NH3还原除去,利用反应6NO2+8NH3$?_{加热}^{催化剂}$7N2+12H2O也可处理NO2.当氧化产物和还原产物的质量差为14g时,转移电子的物质的量为12mol.
 燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.Ⅰ.CH4还原法:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=bkJ•mol-1甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=0.5(a+b)kJ/mol.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
(2)T1< T2(填<,=,>); a<0(填<,=,>)
(3)在T1时,0~10min内内NO2的转化率是50%;欲提高NO2的转化率同时加快反应速率,可采取的措施有B
A.缩小容器体积 B.增大CH4浓度 C.降低温度 D.加入催化剂
Ⅱ. NOx也可以用NH3还原除去,利用反应6NO2+8NH3$?_{加热}^{催化剂}$7N2+12H2O也可处理NO2.当氧化产物和还原产物的质量差为14g时,转移电子的物质的量为12mol.
4.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80% |
3.已知:乙烯是一种无色稍有气味气体,难溶于水,易溶于四氯化碳等有机溶剂:SO2易溶于水,难溶于四氯化碳等有机溶剂.实验室制乙烯时,产生的气体能使溴水褪色,甲、乙同学探究溴水褪色的原因.(气密性已检验,部分夹持装置略).
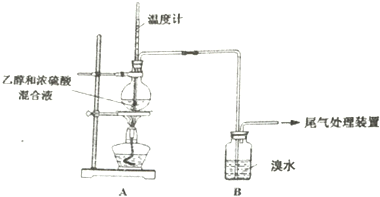
(1)写出生成乙烯的化学方程式CH3-CH2-OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.烧瓶内液体渐渐变黑说明浓硫酸具有脱水性、强氧化 性.
(2)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,C2H4使B中溶液褪色的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br.
②乙根据现象c认为产生了SO2,SO2使B中溶液褪色的化学方程式是SO2+Br2+2H2O=2HBr+H2SO4.
(3)为证实各自观点,甲、乙同学重新实验,各自在A、B间增加一个装有某种试剂的洗气瓶,均观察到溴水褪色.
①根据甲的设计,洗气瓶中盛放的试剂是NaOH溶液.
②乙为进一步验证其观点,取少量反应后的B中溶液,加入少量BaCl2溶液,振荡,产生大量白色沉淀,反应的离子方程式为SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.

| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(2)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,C2H4使B中溶液褪色的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br.
②乙根据现象c认为产生了SO2,SO2使B中溶液褪色的化学方程式是SO2+Br2+2H2O=2HBr+H2SO4.
(3)为证实各自观点,甲、乙同学重新实验,各自在A、B间增加一个装有某种试剂的洗气瓶,均观察到溴水褪色.
①根据甲的设计,洗气瓶中盛放的试剂是NaOH溶液.
②乙为进一步验证其观点,取少量反应后的B中溶液,加入少量BaCl2溶液,振荡,产生大量白色沉淀,反应的离子方程式为SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.
2.下列实验现象预测正确的是( )
| A. | 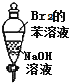 振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 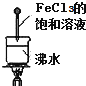 当液体变成红褐色时,停止加热,让光束通过体系时可产生丁达尔效应 |
20.以NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 标准状况下,9g H2O与11.2LO2所含的分子数均为0.5 NA | |
| B. | 假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA | |
| C. | 常温下,14gC2H4与C3H6的混合气体中含有的氢原子总数为2NA | |
| D. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
19.120℃时,将0.1mol某气态烃在足量的氧气中完全燃烧,测得反应前后气体体积相等,则该气态烃可能
( )
( )
| A. | 乙烷 | B. | 乙烯 | C. | 丙烷 | D. | 苯 |
18.有文献记载:在强碱条件下,加热银氨溶液可能析出银镜.某同学进行如表验证和对比实验.
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
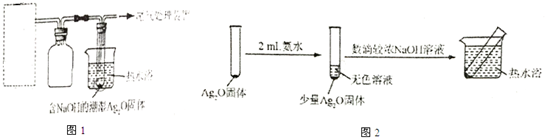
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
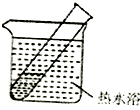
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.
0 170889 170897 170903 170907 170913 170915 170919 170925 170927 170933 170939 170943 170945 170949 170955 170957 170963 170967 170969 170973 170975 170979 170981 170983 170984 170985 170987 170988 170989 170991 170993 170997 170999 171003 171005 171009 171015 171017 171023 171027 171029 171033 171039 171045 171047 171053 171057 171059 171065 171069 171075 171083 203614
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和数滴较浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.
