10.常温下,把10mL2mol•L-1的氢氧化钠溶液分别加到4个盛有不同体积、不同浓度的醋酸溶液的烧杯中,丙加水稀释到50mL,其中反应速率最大的是( )
| A. | 30mL 30mol•L-1 | B. | 25mL 2mol•L-1 | C. | 10mL 1mol•L-1 | D. | 18mL 4mol•L-1 |
9.砷为第4周期ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
| A. | 砷在通常情况下是固体 | |
| B. | 可以存在-3、+3、+5等多种化合物 | |
| C. | As2O5对应水化物的酸性比H3PO4强 | |
| D. | 砷的气态氢化物比磷的气态氢化物稳定性差 |
8.下列能说明氯元素原子得电子能力比硫强的是( )
①HCl的溶解度比H2S大
②HCl溶液的酸性比H2S溶液强
③HCl的稳定性比H2S强
④还原性:Cl-<S2-
⑤HClO的酸性比H2SO4强
⑥Cl2能与H2S反应生成S
⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
①HCl的溶解度比H2S大
②HCl溶液的酸性比H2S溶液强
③HCl的稳定性比H2S强
④还原性:Cl-<S2-
⑤HClO的酸性比H2SO4强
⑥Cl2能与H2S反应生成S
⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
| A. | ①③④⑤ | B. | ②④⑥⑦ | C. | ③④⑥⑦ | D. | 全部 |
7.下列物质中含有共价键的离子化合物是( )
①MgF2 ②NaClO ③NaOH ④NH4Cl ⑤CO2 ⑥N2.
①MgF2 ②NaClO ③NaOH ④NH4Cl ⑤CO2 ⑥N2.
| A. | ②③⑤ | B. | ②③④ | C. | ①②③ | D. | ①③⑤ |
6.下列反应不属于取代反应的是( )
| A. | CH2=CH2+H2$\stackrel{催化剂}{→}$C2H6 | |
| B. | 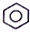 +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$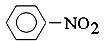 +H2O +H2O | |
| C. | CH3COOCH2CH3+H2O$→_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
5.下列关于原电池的说法正确的是( )
| A. | 原电池中的电极一定要由两种不同的金属组成 | |
| B. | 电子流出的一极是正极 | |
| C. | 任何化学反应都能设计成原电池 | |
| D. | 原电池中的阳离子向正极移动 |
4.铝灰是电解铝或铸造铝生产工艺中产生的熔渣经冷却加工后的产物,其作用成分为金属铝、三氧化二铝、二氧化硅及少量的氧化亚铁、氧化铁等.用铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作或条件略):
Ⅰ.向铝灰中加入过量稀硫酸,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,然后调节溶液的PH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:生成氢氧化物沉淀与PH的关系
(1)写出步骤Ⅱ中加入过量KMnO4溶液时发生反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(2)已知:一定条件下,MnO4-与Mn2+反应生成MnO2.
①向步骤Ⅲ产生的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(3)对Al2(SO4)3粗产品进行定量分析,步骤如图所示:
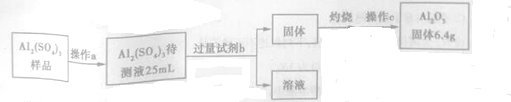
①操作c是称量,所需仪器名称为托盘天平.
②加入试剂b后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
③配制的Al2(SO4)3的待测液中c(Al3+)=5.0mol/L.(保留两位有效数字)
Ⅰ.向铝灰中加入过量稀硫酸,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,然后调节溶液的PH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:生成氢氧化物沉淀与PH的关系
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(2)已知:一定条件下,MnO4-与Mn2+反应生成MnO2.
①向步骤Ⅲ产生的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(3)对Al2(SO4)3粗产品进行定量分析,步骤如图所示:

①操作c是称量,所需仪器名称为托盘天平.
②加入试剂b后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
③配制的Al2(SO4)3的待测液中c(Al3+)=5.0mol/L.(保留两位有效数字)
1.已知在25℃、1.013×105Pa条件下,1molH2在氧气中完全燃烧后放出286KJ热量,1mol水蒸气转化为液态水放出热量为44KJ.其他的相关数据如下表:
则表中a为( )
0 170656 170664 170670 170674 170680 170682 170686 170692 170694 170700 170706 170710 170712 170716 170722 170724 170730 170734 170736 170740 170742 170746 170748 170750 170751 170752 170754 170755 170756 170758 170760 170764 170766 170770 170772 170776 170782 170784 170790 170794 170796 170800 170806 170812 170814 170820 170824 170826 170832 170836 170842 170850 203614
| 物质 | H2(g) | O2(g) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | 496 | a |
| A. | 463 | B. | 260 | C. | 926 | D. | 970 |
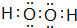 ,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).
,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”). 有机物在社会生产、生活中起着非常重要的作用.
有机物在社会生产、生活中起着非常重要的作用.