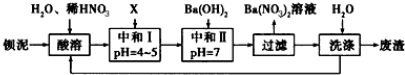
题目内容
3.A、B、C、D、E、F是原子序数由小到大排列的六种短周期元素,其中A、B、C、E的原子序数之和为32,A是元素周期表中原子半径最小的元素,B、C左右相邻,C、E位于同主族,含D元素的物质焰色反应呈黄色.(1)C、D、E元素简单离子半径由大到小的顺序为:S2->O2->Na+(用离子符号表示),写出一个能证明E、F两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓.
(2)A与C组成的一种化合物具有较强的氧化性,其电子式为
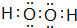 ,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).
,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).(3)已知由A、B、C、E四种元素组成一种离子化合物X,1molX能与足量NaOH溶液反应生成标准状况下44.8L气体,且X既能与盐酸反应,又能与氯水反应.
①写出X的化学式:(NH4)2SO3.
②写出加热条件下X与NaOH溶液反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
分析 A、B、C、D、E、F是原子序数由小到大排列的六种短周期元素,A是元素周期表中原子半径最小的元素,则A为H元素;含D元素的物质焰色反应呈黄色,则D为Na;B、C左右相邻,C、E位于同主族,设B的原子序数为x,则C原子序数为x+1,E原子序数为x+1+8,A、B、C、E的原子序数之和为32,故1+x+x+1+x+1+8=32,解得x=7,故B为N元素,C为O元素,E为S元素,则F为Cl.
(1)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;利用元素单质之间相互置换等可以验证非金属性强弱;
(2)A与C组成的一种化合物具有较强的氧化性,该化合物为H2O2;
(3)由H、N、O、S四种元素组成一种离子化合物X,1molX能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为NH4+,且1molA中含有2molNH4+,且X既能与盐酸反应,又能与氯水反应,则X为(NH4)2SO3.
解答 解:A、B、C、D、E、F是原子序数由小到大排列的六种短周期元素,A是元素周期表中原子半径最小的元素,则A为H元素;含D元素的物质焰色反应呈黄色,则D为Na;B、C左右相邻,C、E位于同主族,设B的原子序数为x,则C原子序数为x+1,E原子序数为x+1+8,A、B、C、E的原子序数之和为32,故1+x+x+1+x+1+8=32,解得x=7,故B为N元素,C为O元素,E为S元素,则F为Cl.
(1)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+,利用元素单质之间的相互转化可以证明非金属性强弱,反应方程式为:Cl2+H2S=2HCl+S↓,
故答案为:S2->O2->Na+;Cl2+H2S=2HCl+S↓;
(2)A与C组成的一种化合物具有较强的氧化性,该化合物为H2O2,电子式为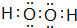 ,含有极性键、非极性键,
,含有极性键、非极性键,
故答案为: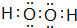 ;极性键、非极性键;
;极性键、非极性键;
(3)由H、N、O、S四种元素组成一种离子化合物X,1molX能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为NH4+,且1molA中含有2molNH4+,且X既能与盐酸反应,又能与氯水反应,则X为(NH4)2SO3,加热条件下X与NaOH溶液反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:(NH4)2SO3;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查位置结构性质的应用、无机物推断等,推断元素是解题关键,需要学生熟练掌握元素化合物性质,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 核电荷为12的原子 | B. | 质子数为8的原子 | ||
| C. | K层为最外层时有2个电子的原子 | D. | 核电荷数为9的原子 |
| A. | 石油分馏能得到石油气、汽油和煤油等清洁能源 | |
| B. | 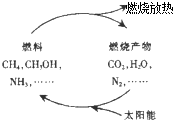 在如图循环转化过程中,太阳能最终转化为热能 | |
| C. | 煤的干馏是指将煤在空气中加热的过程,工业上也叫煤的焦化 | |
| D. | 糖类、油脂、蛋白质是为了人类生命活动提供能量的基本营养物质,都能发生水解反应 |
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐增加 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中阳离子与阴离子数目之比为2:1 |
①HCl的溶解度比H2S大
②HCl溶液的酸性比H2S溶液强
③HCl的稳定性比H2S强
④还原性:Cl-<S2-
⑤HClO的酸性比H2SO4强
⑥Cl2能与H2S反应生成S
⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS.
| A. | ①③④⑤ | B. | ②④⑥⑦ | C. | ③④⑥⑦ | D. | 全部 |
| A. | v(X)正=v(X)逆=0 | |
| B. | v(X):v(Y)=1:2 | |
| C. | 容器内X,Y,Z的浓度不随时间变化 | |
| D. | 单位时间消耗0.1mol X同时生成0.2mol Z |