20.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 | |
| D. | 对乙酰氨基酚分子中核磁共振氢谱出现五组峰,且峰面积之比为3:1:2:2:1 |
18.能正确表示下列反应的离子方程式是( )
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2 Br2+6Cl- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
17.100℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | pH=4的醋酸中:c(H+)=1.0×10-4 mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol•L-1 |
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L二氯甲烷的分子数约为:NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| C. | 17.6g丙烷中所含的极性共价键为3.2NA个 | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量一定减少64g |
15.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2-氯甲苯 |
14.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、H+、S2O32-、PO43- | B. | Pb2+、Hg2+、S2-、SO42- | ||
| C. | Na+、Ba2+、Cl-、OH- | D. | Ca2+、Fe3+、Br-、I- |
13.下列有关甲醇燃料电池的说法中,正确的是( )
| A. | 该电池工作时,甲醇发生燃烧,将热能转化为电能 | |
| B. | 当介质为碱性溶液时,其负极反应为:CH3OH-6e-+H2O═CO2+6H+ | |
| C. | 当介质为酸性溶液时,其负极反应为:O2+4e-+4H+═2H2O | |
| D. | 每摩尔甲醇被氧化时,转移电子的物质的量是6mol |
12.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
0 170417 170425 170431 170435 170441 170443 170447 170453 170455 170461 170467 170471 170473 170477 170483 170485 170491 170495 170497 170501 170503 170507 170509 170511 170512 170513 170515 170516 170517 170519 170521 170525 170527 170531 170533 170537 170543 170545 170551 170555 170557 170561 170567 170573 170575 170581 170585 170587 170593 170597 170603 170611 203614
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O△H>0 |

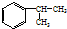 ,A的芳香烃同分异构体(除A外)有7种.
,A的芳香烃同分异构体(除A外)有7种. .反应类型为加成反应.
.反应类型为加成反应. )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式 .
. .
.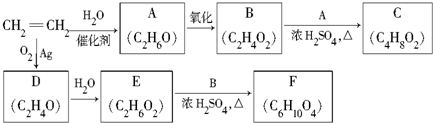
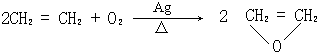 .
.