题目内容
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,22.4L二氯甲烷的分子数约为:NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| C. | 17.6g丙烷中所含的极性共价键为3.2NA个 | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量一定减少64g |
分析 A.气体摩尔体积适用对象为气体;
B.1个二氧化硫含有2个氧原子;
C.丙烷分子中存在8个碳氢共价键,17.6g丙烷的物质的量为0.4mol,含有3.2mol碳氢键;
D.电解精炼铜时,阳极上是粗铜,粗铜上有其他金属杂质.
解答 解:A.标况下,二氯甲烷为液态,不能使用气体摩尔体积,故A错误;
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的个数为0.5NA个,物质的量为0.5mol,故B正确;
C.17.6g丙烷的物质的量为:$\frac{17.6g}{176g/mol}$=0.4mol,0.4mol丙烷中含有极性共价键的物质的量为:8×0.4mol=3.2mol,所含的极性共价键为3.2NA个,故C正确;
D.电解精炼铜时,阳极上是粗铜,粗铜上有其他比铜活泼的金属杂质也会放电,故阴极得到电子数为2NA时,阳极减少的质量不一定是64g,故D错误;
故选:BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积的使用对象和条件.

练习册系列答案
相关题目
20.下列有关碳酸钠、碳酸氢钠的说法中,正确的是( )
| A. | 除去碳酸氢钠固体中混有的少量碳酸钠可以采用加热的方法 | |
| B. | 相同条件下,碳酸钠的溶解度小于碳酸氢钠的溶解度 | |
| C. | 碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠 | |
| D. | 向同浓度的碳酸钠溶液和碳酸氢钠溶液中滴加少量酚酞试液,都能显红色,碳酸氢钠溶液的颜色淡一些 |
7.在化学学习与研究中经常采用“推理”的思维方式.下列“推理”正确的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色,则甲苯也不能使酸性高锰酸钾溶液褪色 | |
| B. | 组成和结构相似的物质,沸点随相对分子质量增大而升高,则SiH4沸点高于CH4 | |
| C. | 加热蒸发食盐水可以得到NaCl(s),则加热蒸发FeCl3溶液可以获得FeCl3(s) | |
| D. | 盐酸和氧化亚铁反应只生成盐和水,则硝酸和氧化亚铁反应也只生成盐和水 |
4.为达到预期的实验目的,下列操作中正确的是( )
| A. | 鉴别AlC13溶液和MgC12溶液:向2种待测液中分别滴加足量氨水 | |
| B. | 可用过滤法分离氢氧化铁胶体和三氯化铁溶液的混合物 | |
| C. | 除去Fe(OH)3固体中少量Mg(OH)2:加入足量浓FeCl3溶液,充分搅拌过滤 | |
| D. | 除去铜器表面的铜绿[Cu2(OH)2CO3]:用硝酸浸泡,再用清水冲洗 |
11.下列说法正确的是( )
| A. | 石油裂解的主要目的是提高轻质液体燃料的产量 | |
| B. | 电解饱和食盐水制造烧碱时,采用离子交换膜可防止氯气进入阴极室 | |
| C. | 硫酸工业中在接触室安装热交换器的目的是利用SO2催化氧化时放出的热量 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
8.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确是( )
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-10mol/L | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
5.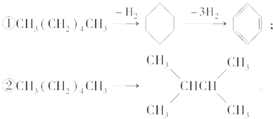 增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )
增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )
 增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )
增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现.例如以下两个在催化重整时发生的反应:则下列叙述不正确的是( )| A. | 石油分馏后得到的汽油远不能满足需求,故常用裂化等方法生产更多的轻质油 | |
| B. | 使用含铅抗爆剂,会导致铅污染,故目前已禁止使用 | |
| C. | ①②均为消去反应 | |
| D. | ①②反应过程中有机物碳原子数均没有发生变化 |
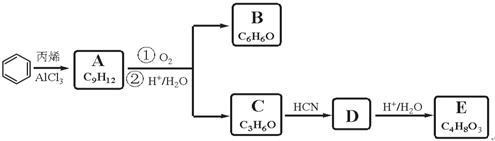
 ,A的芳香烃同分异构体(除A外)有7种.
,A的芳香烃同分异构体(除A外)有7种. .反应类型为加成反应.
.反应类型为加成反应. )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式 .
.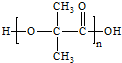 .
.