10.以下所含的化学键类型与晶体熔化需要破坏的作用力类型均相同的是( )
| A. | 干冰与水晶 | B. | 碘片和冰 | ||
| C. | 食盐和蔗糖 | D. | 氢氧化钠和五氧化二磷 |
9.把m mol C2H4和n mol氢气混合于密闭容器中,在适当的条件下生成了p mol C2H6,若将所得的混合气体完全燃烧生成二氧化碳和水,则需氧气( )
| A. | 3.5p mol | B. | (3m+n/2)mol | C. | (3m+n)mol | D. | (3m+n/2-3 p)mol |
8.如图是CH4、CCl4、CH3Cl的分子球棍模型图.下列说法正确的是( )


| A. | CH4、CCl4和CH3Cl都是正四面体结构 | |
| B. | CH4、CCl4都是正四面体结构 | |
| C. | CH3Cl和CCl4常温下都是液体 | |
| D. | CH4、CCl4的结构相同,性质也相同 |
7.下列说法中正确的是( )
| A. | 冰融化时,分子中氢氧键发生断裂 | |
| B. | 原子晶体中共价键越强,熔点和沸点越高 | |
| C. | 分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高 | |
| D. | 分子晶体中分子间作用力越大,该物质越稳定 |
6.下列烃没有同分异构体的是( )
| A. | 丙烷 | B. | 丁烷 | C. | 丁烯 | D. | 戊烷 |
5.某烃分子中有两个双键,它的分子式可能是( )
| A. | C4H6 | B. | C7H8 | C. | C5H10 | D. | C10H22 |
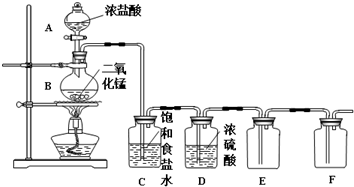
4.某化学兴趣小组用图所示装置制备干燥纯净的氯气,并探究氯气的性质.请回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(选填“大于”、“小于”、“等于”).
(2)兴趣小组的同学准备在F中装入FeCl2溶液以验证Cl2的氧化性,则该反应的化学方程式2FeCl2+3Cl2=2FeCl3.
(3)兴趣小组同学一致认为氯气能使湿润的红色布条褪色,但对于使湿润的红色布条褪色的原因看法不一致,为探究原因,特设计下列实验.(已知:Cl2+H2O?HCl+HClO)
(4)兴趣小组的某同学认为整套实验装置还存在一处明显缺陷,该缺陷是缺乏尾气处理装置.
0 170360 170368 170374 170378 170384 170386 170390 170396 170398 170404 170410 170414 170416 170420 170426 170428 170434 170438 170440 170444 170446 170450 170452 170454 170455 170456 170458 170459 170460 170462 170464 170468 170470 170474 170476 170480 170486 170488 170494 170498 170500 170504 170510 170516 170518 170524 170528 170530 170536 170540 170546 170554 203614
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量为小于0.5mol(选填“大于”、“小于”、“等于”).
(2)兴趣小组的同学准备在F中装入FeCl2溶液以验证Cl2的氧化性,则该反应的化学方程式2FeCl2+3Cl2=2FeCl3.
(3)兴趣小组同学一致认为氯气能使湿润的红色布条褪色,但对于使湿润的红色布条褪色的原因看法不一致,为探究原因,特设计下列实验.(已知:Cl2+H2O?HCl+HClO)
| 提出假设 | 验证假设 | 得出结论 |
| ①能使红色布条褪色是HCl ②能使红色布条褪色是HClO ③能使红色布条褪色是Cl2(写化学式) | 实验①:把红色布条伸入稀盐酸中,红色布条不褪色. 实验②:E、F分别装入A(填标号),干燥的红色布条不褪色,湿润的红色布条褪色. A.干燥的红色布条、湿润的红色布条 B.湿润的红色布条、干燥的红色布条 | 氯水中的HClO (写化学式)能使湿润的红色布条褪色. |

 ,氧化钠的电子式
,氧化钠的电子式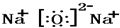 ,CO2的电子式
,CO2的电子式 .
.