题目内容
3.写出下列反应的离子方程式:(1)锌片插入硝酸银溶液中
(2)实验室用大理石制二氧化碳气体
(3)向澄清石灰水中通入过量二氧化碳气体.
分析 (1)单质锌在金属活动顺序表中排在银的前面,锌能与银离子之间发生氧化还原反应;
(2)实验室用稀盐酸 与碳酸钙反应制备二氧化碳气体;
(3)二氧化碳过量,氢氧化钙与二氧化碳反应生成碳酸氢钙.
解答 解:(1)单质锌与银离子之间发生氧化还原反应,离子方程式为:Zn+2Ag+=Zn2++2Ag,
故答案为:Zn+2Ag+=Zn2++2Ag;
(2)实验室中用碳酸钙与稀盐酸反应制取二氧化碳,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)氢氧化钙溶液与过量的二氧化碳反应生成碳酸氢钙,反应的离子方程式为:OH-+CO2=HCO3-,
故答案为:OH-+CO2=HCO3-.
点评 本题考查离子方程式的书写,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
6.下列措施可以提高燃料燃烧效果的是( )
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入足量的空气⑤提高燃料的着火点 ⑥降低燃料的着火点.
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入足量的空气⑤提高燃料的着火点 ⑥降低燃料的着火点.
| A. | ①②③④ | B. | ②③⑤⑥ | C. | ③④⑤⑥ | D. | ①②③④ |
8.如图是CH4、CCl4、CH3Cl的分子球棍模型图.下列说法正确的是( )


| A. | CH4、CCl4和CH3Cl都是正四面体结构 | |
| B. | CH4、CCl4都是正四面体结构 | |
| C. | CH3Cl和CCl4常温下都是液体 | |
| D. | CH4、CCl4的结构相同,性质也相同 |
15.某溶液能与Al粉反应放出H2,该溶液中可能大量共存的离子组是( )
| A. | K+、Fe2+、SO42-、ClO- | B. | NH4+、Mg2+、SO42-、NO3- | ||
| C. | K+、Al3+、S2-、Cl- | D. | Na+、Fe3+、Cl-、SO42- |
12.蛋白质发生的下列过程中,可逆的是( )
| A. | 加入浓硫酸 | B. | 煮熟 | C. | 变性 | D. | 盐析 |
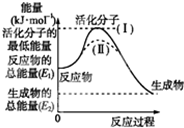 请认真观察图,然后回答问题:
请认真观察图,然后回答问题: