题目内容
11.NH4Cl的电子式 ,氧化钠的电子式
,氧化钠的电子式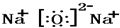 ,CO2的电子式
,CO2的电子式 .
.
分析 氯化铵是由氨根离子与氯离子通过离子键结合而成的离子化合物;
氧化钠是由钠离子与氧离子通过离子键结合而成的离子化合物;
二氧化碳中碳原子与2个氧原子通过共用四对电子形成共价化合物.
解答 解:氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
氧化钠是离子化合物,由钠离子与氧离子构成,电子式为;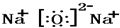 ;
;
二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ;
;
故答案为: ;
;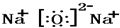 ;
; .
.
点评 本题考查常用化学用语,准确判断物质所含化学键类型、熟练掌握电子式书写方法即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性.制备时将FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5nm~36nm(1nm=10-9m)的磁流体.下列说法正确的是( )
| A. | 所得的分散系属于溶液 | B. | 所得的分散系能产生丁达尔效应 | ||
| C. | 所得的分散系不能通过滤纸 | D. | 磁流体微粒的直径比Fe2+小 |
2.稀硫酸中插一块铜片,加入少量下列物质并充分振荡后,铜可能没有发生反应的是( )
| A. | 硫酸铁晶体 | B. | 浓硝酸 | C. | 硝酸锌晶体 | D. | 浓硫酸 |
19.电解质和非电解质是对化合物的一种分类方式.下列关于电解质的说法正确的是( )
| A. | 液态HCl不导电,所以AgCl不是电解质 | |
| B. | AgCl在水溶液中难导电,但熔融状态下能导电,所以AgCl是电解质 | |
| C. | 电解质一定能导电,能导电的物质一定属于电解质 | |
| D. | CO2溶于水形成的济液能导电,所以CO2是电解质 |
6.下列烃没有同分异构体的是( )
| A. | 丙烷 | B. | 丁烷 | C. | 丁烯 | D. | 戊烷 |
16.铍(Be)与铝的性质相似,已知反应BeCl2+Na2BeO2+2H2O═2NaCl+2Be(OH)2↓能进行完全.据此作出的以下推断中正确的是( )
| A. | 常温时,BeCl2溶液的pH>7 | |
| B. | 常温时,Na2BeO2溶液的pH<7 | |
| C. | Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性较强,说明BeCl2一定是离子化合物 |
3.短周期元素X、Y可以形成化合物XY2.下列有关叙述正确的是( )
| A. | 若XY2是共价化合物,则X与Y的原子序数不可能相差1 | |
| B. | 若XY2是离子化合物,则X和Y的原子序数不可能相差8 | |
| C. | 若X与Y的原子序数相差5,则离子化合物XY2不溶于水 | |
| D. | 若X与Y的原子序数相差6,则共价化合物XY2不可溶于强碱溶液 |
20.下列叙述中正确的是( )
| A. | 液溴应保存于带磨口玻璃塞的广口试剂瓶中,并加水“水封”以减少其易挥发 | |
| B. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| C. | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ | |
| D. | 氨气是一种诚性气体,可用P2O5或无水CaCl2干燥 |
1.下列推断正确的是( )
| A. | Na2O、Na2O2组成元素虽然相同,但与H2O、CO2等反应的产物不完全相同 | |
| B. | SiO2 是酸性氧化物,不溶于水,也不能与任何酸发生反应 | |
| C. | CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在 | |
| D. | 浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体 |