3.纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①某同学根据上述信息,某同学推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
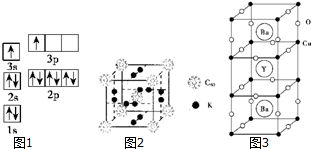
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.A原子杂化类型是sp.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确不正确理由是因为C60构成的晶体是分子晶体,影响分子晶体熔点的作用是分子间作用力;而金刚石构成的晶体是原子晶体,影响原子晶体熔点的作用是原子间共价键,共价键作用大大与分子间作用力,因此金刚石的熔点高于C60.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为3:1.晶胞中每个C60分子周围与之等距离且最近的C60分子数是6.
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖.其晶胞结构如图3.
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式YBa2Cu3O7.
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比2:1.
③Ba2+的配位数为10.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |

②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.A原子杂化类型是sp.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确不正确理由是因为C60构成的晶体是分子晶体,影响分子晶体熔点的作用是分子间作用力;而金刚石构成的晶体是原子晶体,影响原子晶体熔点的作用是原子间共价键,共价键作用大大与分子间作用力,因此金刚石的熔点高于C60.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为3:1.晶胞中每个C60分子周围与之等距离且最近的C60分子数是6.
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖.其晶胞结构如图3.
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式YBa2Cu3O7.
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比2:1.
③Ba2+的配位数为10.
19.下列化学用语的使用正确的是( )
| A. | 氯化铵的电子式为  | |
| B. | 重氢负离子(${\;}_{1}^{2}$H-)的结构示意图为 | |
| C. | 次氯酸的结构式为H-Cl-O | |
| D. | 中子数为19的钙离子为${\;}_{19}^{40}$Ca2+ |
17.2015年2月28,前央视记者柴静的雾霾调查纪录片《穹顶之下》在各大社交网站上热播.该片极大地激发了人们对环境问题的关注和忧虑.下列有关环境问题的说法中正确的是( )
| A. | 煤、石油等化石燃料燃烧过程中排放的废气是形成酸雨的主要原因,酸雨指的是PH值小于7的雨水 | |
| B. | 煤和石油都属于一级能源而天然气属于二级能源 | |
| C. | 在煤中添加适量的石膏可减少燃烧过程中含硫化合物的排放从而减少污染 | |
| D. | 雾霾可能是许多细小液体和固体微粒分散到空气中形成的一种气溶胶 |
16.某同学探究氮氧化物的性质,将一定量的NO2通入到足量的碳酸氢钠溶液,并将生成的气体全部通过足量过氧化钠,充分反应后,用排水法收集所得气体为( )
| A. | O2 | B. | CO2 | C. | NO | D. | NO和CO2 |
15.几种微粒具有相同的核电荷数,则可说明( )
0 170303 170311 170317 170321 170327 170329 170333 170339 170341 170347 170353 170357 170359 170363 170369 170371 170377 170381 170383 170387 170389 170393 170395 170397 170398 170399 170401 170402 170403 170405 170407 170411 170413 170417 170419 170423 170429 170431 170437 170441 170443 170447 170453 170459 170461 170467 170471 170473 170479 170483 170489 170497 203614
| A. | 核外电子数一定相等 | B. | 一定是同一元素 | ||
| C. | 彼此之间一定是同位素 | D. | 可能是同一元素 |
 .
. .
.
 A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族.B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水.A和E可形成离子化合物,其晶胞结构如图所示.
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族.B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水.A和E可形成离子化合物,其晶胞结构如图所示. .
.