题目内容
18.元素周期律在帮助我们学习和预测元素及其化合物性质方面具有重要的指导意义.下列有关说法中正确的是( )①锂在空气中剧烈燃烧,产物为Li2O2,其水溶液呈强碱性
②在卤素氢化物中HF最稳定
③H2Se(硒化氢)是一种无色、有毒,比H2S稳定性强的气体
④SrSO4(硫酸锶)是一种难溶于水的白色固体
⑤Tl(OH)与盐酸或氢氧化钠溶液都能反应生成盐和水
⑥At单质为有色固体,AgAt既难溶于水也难溶于硝酸.
| A. | ①②③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ①②③⑤ |
分析 ①Li燃烧生成Li2O,碱金属从上到下,金属性增强,最高价氧化物对应水化合物碱性增强;
②元素非金属性强,氢化物的稳定性强;
③元素的非金属性越强,其氢化物的稳定性越强;
④同主族元素化合物的性质具有相似性和递变性;
⑤两性氢氧化物与盐酸或氢氧化钠溶液都能反应生成盐和水;
⑥卤族元素单质从上到下,单质由气体过渡为固体,颜色逐渐加深,AgAt具有AgCl的相似的性质.
解答 解:①Li燃烧生成Li2O,从上到下,金属性增强,则LiOH为弱碱,故错误;
②在卤素中F元素的非金属性最强,所以氢化物中HF最稳定,故正确;
③非金属性越强,气态氢化物越稳定,非金属性:S>Se,则氢化物稳定性为:H2S>H2Se,故错误;
④第ⅡA元素硫酸盐性质的递变规律,硫酸钡(BaSO4)是难溶于水的白色固体,则硫酸锶(SrSO4)是难溶于水的白色固体,故正确;
⑤Tl(OH)属于强碱,不是两性氢氧化物,只能和与盐酸溶液反应生成盐和水,和强碱溶液之间不反应,故错误;
⑥卤族元素单质从上到下,单质由气体过渡为固体,颜色逐渐加深,AgAt具有AgCl的相似的性质,不溶于水也不溶于稀硝酸,故正确;
故选C.
点评 本题考查同主族元素和同周期元素的性质变化规律以及对角线原则,为高频考点,侧重于基础知识的考查,题目难度不大,注意把握元素规律的运用.

练习册系列答案
相关题目
17.下列分子中所有原子都满足最外层为8电子稳定结构的是( )
| A. | H2O2 | B. | CO2 | C. | PCl5 | D. | BF3 |
6.某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
| A. | X的最高化合价为+4 | |
| B. | X是第二周期VA族元素 | |
| C. | X是第二周VIA族元素 | |
| D. | X的最高价含氧酸的分子式可表示为H3XO4 |
13.下列装置或操作能达到实验目的是( )
| A. | 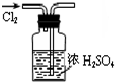 干燥Cl2 | B. | 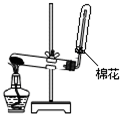 实验室制取并收集NH3 | ||
| C. | 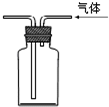 利用排空法收集CO2 | D. | 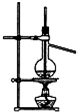 石油的分馏 |
3.纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①某同学根据上述信息,某同学推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
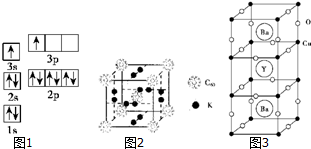
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.A原子杂化类型是sp.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确不正确理由是因为C60构成的晶体是分子晶体,影响分子晶体熔点的作用是分子间作用力;而金刚石构成的晶体是原子晶体,影响原子晶体熔点的作用是原子间共价键,共价键作用大大与分子间作用力,因此金刚石的熔点高于C60.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为3:1.晶胞中每个C60分子周围与之等距离且最近的C60分子数是6.
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖.其晶胞结构如图3.
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式YBa2Cu3O7.
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比2:1.
③Ba2+的配位数为10.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |

②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.A原子杂化类型是sp.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确不正确理由是因为C60构成的晶体是分子晶体,影响分子晶体熔点的作用是分子间作用力;而金刚石构成的晶体是原子晶体,影响原子晶体熔点的作用是原子间共价键,共价键作用大大与分子间作用力,因此金刚石的熔点高于C60.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为3:1.晶胞中每个C60分子周围与之等距离且最近的C60分子数是6.
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖.其晶胞结构如图3.
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式YBa2Cu3O7.
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比2:1.
③Ba2+的配位数为10.
10.下列物质属于天然高分子化合物的是( )
| A. | 油脂 | B. | 合成橡胶 | C. | 聚乙烯 | D. | 蛋白质 |
8.金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
| A. | 金刚石比石墨稳定 | B. | 1mol石墨比1mol金刚石的总能量低 | ||
| C. | 石墨比金刚石稳定 | D. | 1mol石墨比1mol金刚石的总能量高 |
 (1)甲醇可为燃料电池的原料.以CH4和H2O为原料,通过下列反应制备甲醇.
(1)甲醇可为燃料电池的原料.以CH4和H2O为原料,通过下列反应制备甲醇. 反应类型取代反应
反应类型取代反应