20.实验室用足量锌粉与一定量的某浓度的盐酸反应来制氢气.由于反应速率太快,不易操作.为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是( )
| A. | K2SO4固体 | B. | NaOH溶液 | C. | 少量CuSO4溶液 | D. | CH3COONa固体 |
17.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.

操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.(如图1)
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)端管口通入.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.
(3)步骤①“不断分离除去反应生成的水”该操作的目的是:使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中,用10%Na2C03溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).(如图2)
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”)原因是会收集到少量未反应的冰醋酸和正丁醇.
| 化合物 | 相对分子质量 | 密度/g/cm3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |

操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.(如图1)
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)端管口通入.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH
 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.(3)步骤①“不断分离除去反应生成的水”该操作的目的是:使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中,用10%Na2C03溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).(如图2)
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”)原因是会收集到少量未反应的冰醋酸和正丁醇.
16. 某研究小组用HNO2与大理石的反应来研究影响反应速度的因素,所用HNO2浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO2的用量为25.0mL、大理石用量为10.00g.
某研究小组用HNO2与大理石的反应来研究影响反应速度的因素,所用HNO2浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO2的用量为25.0mL、大理石用量为10.00g.
(1)请完成以下实验,并在实验目的一栏中回答有关问题:
(2)实验①中CO2的体积随时间变化的关系如图所示:OE,EF,FG三段中,EF段化学反应速率最快,EF段收集的二氧化碳最多.
 某研究小组用HNO2与大理石的反应来研究影响反应速度的因素,所用HNO2浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO2的用量为25.0mL、大理石用量为10.00g.
某研究小组用HNO2与大理石的反应来研究影响反应速度的因素,所用HNO2浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO2的用量为25.0mL、大理石用量为10.00g.(1)请完成以下实验,并在实验目的一栏中回答有关问题:
| 实验编号 | T/K | 大理石 规格 | C(HNO2)/mol.L | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | Ⅰ、实验①和②探究浓度对该反应速率的影响; Ⅱ、实验①和实验③探究温度对该反应速率的影响; Ⅲ、实验①和实验④探究大理石规格(粗、细)对该反应速率的影响. |
② | 298 | 粗颗粒 | 1.00 | |
| ③ | ||||
| ④ |
15.下列有机物命名不正确的是( )
| A. | 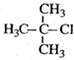 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | B. | 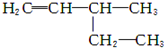 3-乙基-1-丁烯 3-乙基-1-丁烯 | ||
| C. | 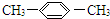 1,4-二甲苯 1,4-二甲苯 | D. | 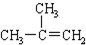 2-甲基丙烯 2-甲基丙烯 |
14.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
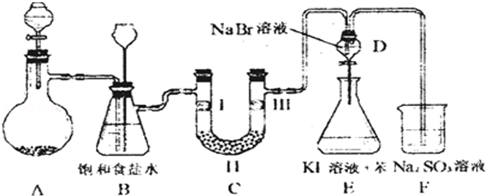
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入d.
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯的非金属性大于溴.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,判断改用NaHSO3溶液是否可行否(填“是”或“否”).

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
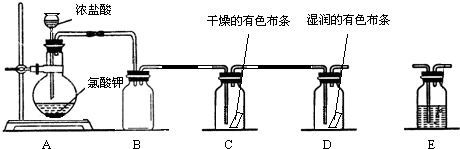
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,判断改用NaHSO3溶液是否可行否(填“是”或“否”).
13.某有机物结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该有机物分子式为:C10H8O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 1 mol该有机物分别与足量NaOH溶液、NaHCO3溶液完全反应,消耗NaOH、NaHCO3的物质的量分别为4mol、1 mol | |
| D. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 |
12.做化学实验时,发生下列事故,处理方法不正确的是( )
| A. | 金属钠着火,用泡沫灭火器扑灭 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑灭 | |
| C. | 皮肤溅上浓HNO3,立即用大量水冲洗,再用小苏打水洗涤 | |
| D. | 汞洒落地面,应立即用硫粉覆盖 |
11. 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
0 170188 170196 170202 170206 170212 170214 170218 170224 170226 170232 170238 170242 170244 170248 170254 170256 170262 170266 170268 170272 170274 170278 170280 170282 170283 170284 170286 170287 170288 170290 170292 170296 170298 170302 170304 170308 170314 170316 170322 170326 170328 170332 170338 170344 170346 170352 170356 170358 170364 170368 170374 170382 203614
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )| A. | 原合金质量为0.92g | B. | 产生氢气0.04mol | ||
| C. | 图中m值为1.56g | D. | 图中V2为60 mL |

 .
. 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.