题目内容
20.实验室用足量锌粉与一定量的某浓度的盐酸反应来制氢气.由于反应速率太快,不易操作.为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是( )| A. | K2SO4固体 | B. | NaOH溶液 | C. | 少量CuSO4溶液 | D. | CH3COONa固体 |
分析 减慢化学反应速率且又不影响生成氢气的总量,说明加入的物质不和稀盐酸反应,且能降低溶液中氢离子浓度,据此分析解答.
解答 解:A.加入硫酸钾固体,溶液中氢离子浓度不变,所以反应速率不变,故A错误;
B.加入NaOH溶液,NaOH和稀盐酸反应生成氯化钠和水,导致生成氢气质量减少,故B错误;
C.加入少量硫酸铜溶液,锌置换出Cu,Zn、Cu和稀盐酸构成原电池而加快反应速率,故C错误;
D.加入醋酸钠固体,生成醋酸,醋酸是弱电解质,导致溶液中氢离子浓度降低,反应速率减小,且最终酸电离出氢离子物质的量不变,所以生成氢气总量不变,故D正确;
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,明确外界条件对化学反应速率影响实质是解本题关键,注意题干中限制性条件,为易错题.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
1.下列有关实验装置进行的相应实验,能达到实验目的是( )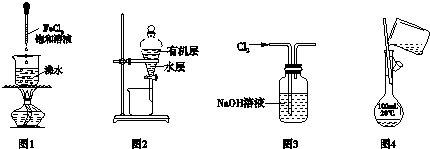

| A. | 用图1制备氢氧化铁胶体,当溶液至红褐色时继续煮沸 | |
| B. | 用图2所示装置分离CCl4萃取碘水后已分层的有机层和水层 | |
| C. | 用图3所示装置除去Cl2中含有的少量HCl气体 | |
| D. | 用图4所示装置配制实验所需100mL0.1mol/LNaCl溶液 |
11.往10mL 1mol/L AlCl3加入1mol/L NaOH溶液,得沉淀0.39g,则所加氢氧化钠溶液的体积可能为( )
| A. | 5 mL | B. | 25 mL | C. | 35 mL | D. | 45mL |
8.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
| A. | 8NH3+3Cl2═6NH4Cl+N2 | B. | Cl2+2HI═I2+2HCl | ||
| C. | 2Na2O2+2H2O═4NaOH+O2 | D. | Ca(OH)2+2HCl═CaCl2+2H2O |
15.下列有机物命名不正确的是( )
| A. | 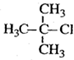 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | B. | 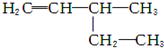 3-乙基-1-丁烯 3-乙基-1-丁烯 | ||
| C. | 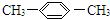 1,4-二甲苯 1,4-二甲苯 | D. | 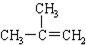 2-甲基丙烯 2-甲基丙烯 |
5.实验室里做钠跟水反应的实验时,用到的仪器和药品是( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤烧杯 ⑥石棉网⑦玻璃片 ⑧药匙.
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤烧杯 ⑥石棉网⑦玻璃片 ⑧药匙.
| A. | ①②③④ | B. | ②③④⑤⑦ | C. | ①③④⑥⑧ | D. | ②⑤⑥⑦⑧ |
12.下列说法正确的是( )
| A. | CH2Cl2与C2H4Br2均无同分异构体 | B. | C2H6与C3H8一定互为同系物 | ||
| C. | 在光照条件下乙烷能使氯水褪色 | D. | 烷烃在常温下均为气态 |
9.用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 常温常压下,22.4L氧气含分子数为NA个O2 | |
| B. | 1molNa2O2化合物中有2mol阴离子和2mol阳离子 | |
| C. | 2.3g金属钠变为钠离子失去电子数为0.1NA | |
| D. | .常温下,1 L 0.5 mol•L-1 NH4Cl溶液中含有3.01×1023个NH4+ |
10.月球的矿产资源极为丰富,仅月面表层5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[(Mg或Fe)2SiO4]等,下列说法或分析不正确的是( )
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 橄榄石中铁为+2价 | |
| C. | 月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 | |
| D. | 斜长石的氧化物形式可表示为:K2O•Al2O3•3SiO2 |