1.短周期元素Q、W、Y原子序数依次增大,原子结构及性质如表所示:
(1)Y在元素周期表中的位置是第三周期ⅢA族.
(2)短周期中与W同主族元素的最高价氧化物的化学式SO3.
(3)元素Q的氧化物(溫室气体)、氢化物属于共价化合物(填“离子”、或“共价”),这些化合物分子内微粒间存在的作用力属于共价键(填离子键或共价键).
(4)单质Y可以发生如图所示的变化,回答:
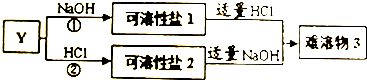
①写出反应①的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
②下列化合物可替代Y发生如图所示的变化的是AC(填选项).
A、Y2O3 B、Y2(SO4)3 C、Y(OH)3 D、Y(NO3)3
③写出难溶物3的化学式Al(OH)3.
| 元素 | 结构与性质 |
| Q | Q元素的最高正、负价代数和为0.最高价氧化物为温室气体之一• |
| W | W是地壳中含量最高的非金属元素. |
| Y | Y所处的周期序数与主族序数相等,为地壳中含量最高的金属元素. |
(2)短周期中与W同主族元素的最高价氧化物的化学式SO3.
(3)元素Q的氧化物(溫室气体)、氢化物属于共价化合物(填“离子”、或“共价”),这些化合物分子内微粒间存在的作用力属于共价键(填离子键或共价键).
(4)单质Y可以发生如图所示的变化,回答:

①写出反应①的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
②下列化合物可替代Y发生如图所示的变化的是AC(填选项).
A、Y2O3 B、Y2(SO4)3 C、Y(OH)3 D、Y(NO3)3
③写出难溶物3的化学式Al(OH)3.
20.原电池的构造如图所示,下列说法不正确的是( )
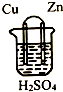

| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由铜片流向锌片 | |
| D. | 该电池工作时,H+在铜片上得电子被还原生成H2逸出 |
17.下列说法中正确的是( )
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | 核外电子排布相同的微粒,化学性质相同 | |
| C. | 所有物质中均存在化学键 | |
| D. | 离子化合物中一定含有离子键 |
15.现有部分短周期元素的性质或原子结构如下表:
(1)元素T在周期表中的位置是第三周期VIA族;
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数是原子核外电子层数的2倍 |
| X | 原子最外层电子数是次外层的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正化合价是+7价 |
(2)元素X的一种同位素可用于测定文物年代,这种同位素的符号是146C;
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填字母);
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物对应的水化物中,其中一种在水中电离程度明显不同于其他三种的是H2CO3(填化学式).
14.医学界通过用${\;}_{\;}^{14}$C标记的C60发现的一种C60的羟酸衍生物,这种羟酸衍生物在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖.下列有关${\;}_{\;}^{14}$C的正确叙述是( )
| A. | 与12C60的碳原子化学性质不同 | B. | 与14N含的中子数相同 | ||
| C. | 是12C60的同素异形体 | D. | 与12C互为同位素 |
13.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.
请回答:
(1)基态c原子核外存在4对自旋相反的电子,其基态原子的价电子排布图为 .
.
(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)a元素最高价氧化物对应水化物的酸根离子的空间构型为平面三角形,中心原子的轨道杂化类型为sp3杂化.
(4)c的氢化化极易溶于水,除因为与水分子之间易形成氢键处,还因为氨气与水分子都是极性分子,相似相溶.
(5)d可形成面心立方最密堆积的晶体,若d的相对分子质量为M,密度为ag•cm-3,则d晶胞的体积为$\frac{4M}{{aN}_{A}}$cm3(用M、a表示,阿伏加德罗常数的值用NA表示).
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 基态原子M层全充满,N层只有一个电子 |
(1)基态c原子核外存在4对自旋相反的电子,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)a元素最高价氧化物对应水化物的酸根离子的空间构型为平面三角形,中心原子的轨道杂化类型为sp3杂化.
(4)c的氢化化极易溶于水,除因为与水分子之间易形成氢键处,还因为氨气与水分子都是极性分子,相似相溶.
(5)d可形成面心立方最密堆积的晶体,若d的相对分子质量为M,密度为ag•cm-3,则d晶胞的体积为$\frac{4M}{{aN}_{A}}$cm3(用M、a表示,阿伏加德罗常数的值用NA表示).
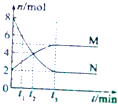
12. 在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
0 170169 170177 170183 170187 170193 170195 170199 170205 170207 170213 170219 170223 170225 170229 170235 170237 170243 170247 170249 170253 170255 170259 170261 170263 170264 170265 170267 170268 170269 170271 170273 170277 170279 170283 170285 170289 170295 170297 170303 170307 170309 170313 170319 170325 170327 170333 170337 170339 170345 170349 170355 170363 203614
 在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 状态Ⅱ和状态ⅢCO2的转化率相同 | |
| B. | 体系的总压强PⅢ:P总(状态Ⅱ)>2PⅠ (状态Ⅰ) | |
| C. | 反应的平衡常数:KⅠ>KⅡ=KⅢ | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
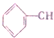 =CH2 D.
=CH2 D.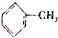
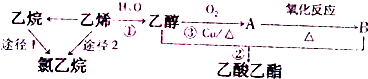
 研究化学反应的快慢和限度具有十分重要的意义,请回答下列问题:
研究化学反应的快慢和限度具有十分重要的意义,请回答下列问题: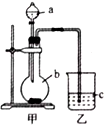 某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.