9.据图判断下列说法正确的是( )


| A. | 图1中醋酸电离平衡常数:a点的比b点的小 | |
| B. | 图1中醋酸溶液的pH:a点的比b点的小 | |
| C. | 图2中c点对应的溶液为Fe(OH)3的不饱和溶液 | |
| D. | 由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH约为4左右 |
8.常温下,下列各组离子一定能大量共存的是( )
| A. | c(OH-)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br - | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | c(OH-)/c(H+)=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的c(H+)=1.0×10-13 mol/L的溶液中:K+、NH4+、AlO2-、HCO3- |
7.对室温下100mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
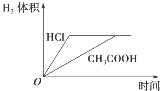

| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
6.根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
| A. | 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
5.下列常数表达式不正确的是( )
| A. | ClO -水解平衡常数表达式为Kh=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$ | |
| B. | NH3•H2O的电离平衡常数表达式为Kb=$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | |
| C. | PbI2溶度积常数表达式为Ksp=c(Pb2+)•c2(I-) | |
| D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$ |
4.下列与能源及能量变化相关的叙述正确的是( )
| A. | 铝热剂焊接钢轨主要利用的是光能 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 1g氢气燃烧生成液态水,放出的热量为142.9 kJ,故氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
2.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL同浓度盐酸,加入同一种镁铝合金粉末,产生气体,有关数据如表:
则下列说法正确的是( )
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.009 mol |
1.设NA为阿伏加德罗常数,下列说法正确的是( )
0 170015 170023 170029 170033 170039 170041 170045 170051 170053 170059 170065 170069 170071 170075 170081 170083 170089 170093 170095 170099 170101 170105 170107 170109 170110 170111 170113 170114 170115 170117 170119 170123 170125 170129 170131 170135 170141 170143 170149 170153 170155 170159 170165 170171 170173 170179 170183 170185 170191 170195 170201 170209 203614
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 标准状况下,11.2 L的SO3所含分子数为0.5NA | |
| D. | 室温下,8 g甲烷含有共价键数为2NA |
