用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
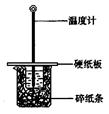
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会 __ __
(5)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
(Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
(Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
该小组在设计方案时,考虑了浓度、a:___________b:___________等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:_____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生反应的化学方程式:______________________。
②实验结果说明催化剂作用的大小与________________有关。
 H2(g)
H2(g) 2NH3(g) △H= -92.6 kJ / mol。测得数据如下表:
2NH3(g) △H= -92.6 kJ / mol。测得数据如下表: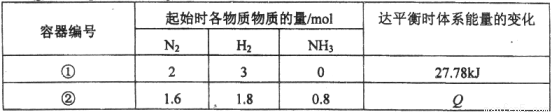
 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
 中的______________、_____________(填字母编号)。
中的______________、_____________(填字母编号)。 N2O4(g)。
N2O4(g)。
 CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。
mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。 位时间内生成amolCO2的同时消耗amolH2
位时间内生成amolCO2的同时消耗amolH2 人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有: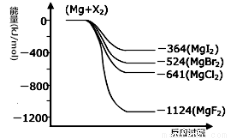
 J?mol—1
J?mol—1 的一个课题,污染分为空气污染,水污染,土壤污染等。
的一个课题,污染分为空气污染,水污染,土壤污染等。 ,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图
,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图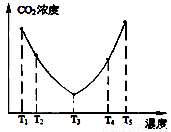
 )通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。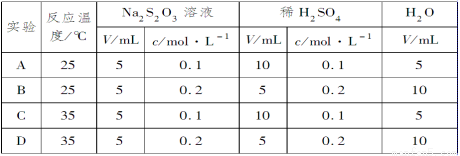
 1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量 燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1
燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1