7.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g),经过一段时间后达到平衡.反应过程中测定的t/s-n(PCl3)/mol数据如图.下列说法正确的是( )

| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| C. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% |
6.如表实验操作、现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向溶液中先滴加BaCl2溶液,再滴加稀盐酸 | 滴加BaCl2后出现白色沉淀,再滴加稀盐酸沉淀不溶解 | 溶液中一定含有SO42- |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
5.下列说法正确的是( )
| A. | 发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品 | |
| B. | 硅太阳能电池板在工作时,可以将化学能转化为电能 | |
| C. | 工业上分别用热还原法、加热法和电解法冶炼镁、铝和铜 | |
| D. | 232Th 转换成233U是化学变化,233U和235U的化学性质几乎相同 |
3.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
| 操 作 | 现 象 |
通入氯气至过量 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
1.将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )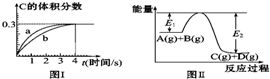

| A. | 该温度下,反应的平衡常数数值约为7.36 | |
| B. | 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 | |
| C. | 反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol•L-1•s-1 | |
| D. | 在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小 |
20.有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
0 169798 169806 169812 169816 169822 169824 169828 169834 169836 169842 169848 169852 169854 169858 169864 169866 169872 169876 169878 169882 169884 169888 169890 169892 169893 169894 169896 169897 169898 169900 169902 169906 169908 169912 169914 169918 169924 169926 169932 169936 169938 169942 169948 169954 169956 169962 169966 169968 169974 169978 169984 169992 203614
| A. | 15种 | B. | 13种 | C. | 11种 | D. | 9种 |
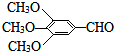 )和抗癫痫药物H(
)和抗癫痫药物H(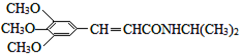 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):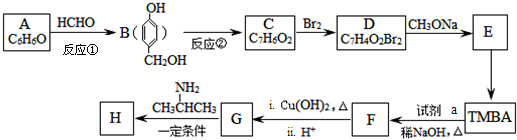
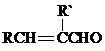 +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢)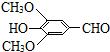 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→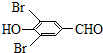 +2HBr.
+2HBr.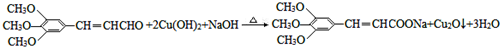 .
. )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 +NaOH→
+NaOH→ +H2NCH(CH3).
+H2NCH(CH3). 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;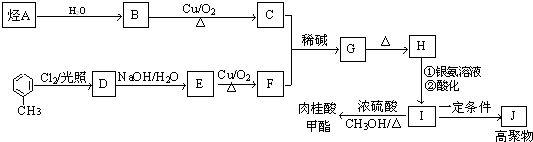
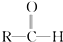 +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$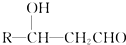 $→_{△}^{-H_{2}O}$RCH=CHCHO
$→_{△}^{-H_{2}O}$RCH=CHCHO ;J的结构简式为
;J的结构简式为 ;
;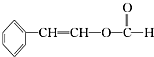 、
、 、
、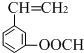 、
、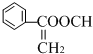 .
.