7.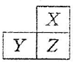 X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
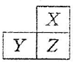 X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物的热稳定性:X<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | X和Z形成的化合物只有共价键 |
5.a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族,a的原子结构示意图为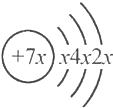 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )
 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 氢化物的稳定性:a>c>d | ||
| C. | 原子半径:d>a>c | D. | 最高价含氧酸的酸性:d>c>a |
4.某元素X的最高价含氧酸的化学式为HnXO2n-2,则在某气态氢化物中,X元素的化合价为( )
| A. | 5n-12 | B. | 3n-12 | C. | 3n-6 | D. | n-10 |
1.下列金属治炼的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | ||
| C. | Fe3O4+3CO$\frac{\underline{\;高温\;}}{\;}$3Fe+3CO2 | D. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O |
18.部分短周期元素的原子结构及相关性质如表所示:
请回答:
(1)T在元素周期表中的位置为第三周期第ⅥA族.
(2)X的一种同位素可用于测定文物年代,该同位素为614C(用原子符号表示).
(3)Z单质的电子式为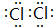 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是d(填选项字母)
a.常温下,Z单质为气体,T单质为固体
b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高
d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生化合反应,产物中含有的化学键类型为离子键、共价键.
0 169116 169124 169130 169134 169140 169142 169146 169152 169154 169160 169166 169170 169172 169176 169182 169184 169190 169194 169196 169200 169202 169206 169208 169210 169211 169212 169214 169215 169216 169218 169220 169224 169226 169230 169232 169236 169242 169244 169250 169254 169256 169260 169266 169272 169274 169280 169284 169286 169292 169296 169302 169310 203614
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次电子数次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(1)T在元素周期表中的位置为第三周期第ⅥA族.
(2)X的一种同位素可用于测定文物年代,该同位素为614C(用原子符号表示).
(3)Z单质的电子式为
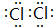 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是d(填选项字母)
a.常温下,Z单质为气体,T单质为固体
b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高
d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生化合反应,产物中含有的化学键类型为离子键、共价键.
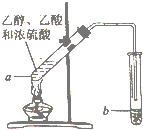 用如图所示的实驗装置制备少置乙酸乙酯.请回答有关问题:
用如图所示的实驗装置制备少置乙酸乙酯.请回答有关问题: CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应).
CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应).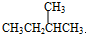 与
与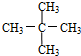 G.
G.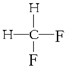 与
与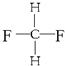
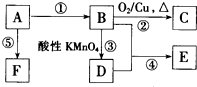 已知A、B、C、D、E、F是中学化学中常见的六中有机物,它们的转化关系如图所示(部分物质已省略).其中A是一种生物生长调节剂,E具有水果香味,F是一种可制成多种包装材料的高分子化合物.
已知A、B、C、D、E、F是中学化学中常见的六中有机物,它们的转化关系如图所示(部分物质已省略).其中A是一种生物生长调节剂,E具有水果香味,F是一种可制成多种包装材料的高分子化合物. CH3COOC2H5+H2O;⑤nCH2=CH2$\stackrel{催化剂}{→}$
CH3COOC2H5+H2O;⑤nCH2=CH2$\stackrel{催化剂}{→}$ .
.