4.下列说法正确的( )
| A. | K+、Na+、NO3-、CO32-在碱性溶液中能大量共存 | |
| B. | Na+ K+ OH- Cl-在强酸性溶液中能大量共存 | |
| C. | Cu2+、H+、NO3-、SO42-能形成无色透明的溶液 | |
| D. | Ba2+、Na+、Cl-、SO42-在溶液中不能大量共存 |
3.已知:在同一反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.在一定条件下KClO3与I2按下式反应:2KClO3+I2═2KIO3+Cl2,下列判断正确的是( )
| A. | 该反应属于置换反应 | B. | 还原剂为KClO3,氧化剂为I2 | ||
| C. | 还原性:I2>KIO3 | D. | 氧化性:KClO3>KIO3 |
18.反应A(s)=D(g)+E(g),已知△G=△H-T△S=(-4500+11T)J/mol;要防止该反应发生,温度必须( )
| A. | 低于136K | B. | 高于409K | ||
| C. | 高于136K而低于409K | D. | 低于409K |
17.硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+ 假设2:只有Fe3+
假设3:既有Fe2+又有Fe3+.
(2)如何证明步骤①滤液中含有Fe2+取少量滤液加入试管中,先滴加KSCN溶液,溶液不变色,再滴加氯水(或双氧水、稀硝酸),溶液变为血红色.
(3)步骤④中一系列处理的操作步骤:过滤、洗涤、灼烧、冷却、称量.
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定.
①用离子方程式表示该滴定原理:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需250mL容量瓶.
重复滴定三次,消耗1.00mol/L KMnO4标准溶液体积分别为19.98mL、20.00mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00mL.请根据以上数据,再设计合理数据,完成下列实验过程的记录表格.(必须填满)
③如何判断达到滴定终点:滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,30秒内不恢复.
0 169018 169026 169032 169036 169042 169044 169048 169054 169056 169062 169068 169072 169074 169078 169084 169086 169092 169096 169098 169102 169104 169108 169110 169112 169113 169114 169116 169117 169118 169120 169122 169126 169128 169132 169134 169138 169144 169146 169152 169156 169158 169162 169168 169174 169176 169182 169186 169188 169194 169198 169204 169212 203614

请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+ 假设2:只有Fe3+
假设3:既有Fe2+又有Fe3+.
(2)如何证明步骤①滤液中含有Fe2+取少量滤液加入试管中,先滴加KSCN溶液,溶液不变色,再滴加氯水(或双氧水、稀硝酸),溶液变为血红色.
(3)步骤④中一系列处理的操作步骤:过滤、洗涤、灼烧、冷却、称量.
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定.
①用离子方程式表示该滴定原理:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需250mL容量瓶.
重复滴定三次,消耗1.00mol/L KMnO4标准溶液体积分别为19.98mL、20.00mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00mL.请根据以上数据,再设计合理数据,完成下列实验过程的记录表格.(必须填满)
| 实验编号 | Fe2+溶液的 体积/mL | |||
| 1 | 20.00 | |||
| 2 | 20.00 | |||
| 3 | 20.00 |
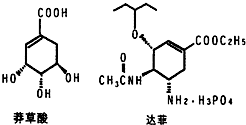 目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).
目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).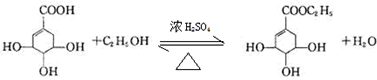 .
. .
.