17.如图水槽中盛装的是海水,其中铁被腐蚀最慢的是( )
| A. |  | B. | 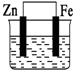 | C. |  | D. |  |
16.下列装置或操作能达到目的是( )
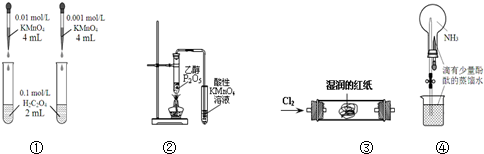

| A. | 装置①依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 装置②证明CH3CH2OH发生消去反应生成了乙烯 | |
| C. | 装置③观察红纸褪色证明氯气具有漂白性 | |
| D. | 打开装置④中的止水夹,挤出胶头滴管中的液体,可观察到红色的喷泉 |
15.下列实验能达到目的是( )
| A. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| B. | 用Cu与S共热制备CuS | |
| C. | 用品红和盐酸检验Na2SO3和Na2CO3 | |
| D. | 将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
14.下列说法不正确的是( )
| A. | 草木灰(含有K2CO3)水溶液可以用于洗涤油污 | |
| B. | 用海沙代替河沙作建房钢筋混凝土材料以节约成本 | |
| C. | 捕获工业排放的CO2能降低地球的温室效应 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 常温下,0.1mol/LHCl溶液中所含的H+个数为0.1NA | |
| C. | 11.2L 的CO气体与0.5molN2所含的电子数相等 | |
| D. | 10gH218O中所含的中子数为5NA |
12.2012年1月16日在阿联酋首都阿布扎比举行的“2012年世界未来能源峰会”上,联合国秘书长潘基文启动联合国“人人享有可持续能源国际年”.下列不能体现“可持续”理念的是( )
| A. | 应用高效洁净的能源转换技术,推广使用节能环保材料 | |
| B. | 大力发展火力发电,解决电力紧张问题 | |
| C. | 研发以高纯硅为核心材料的光伏发电技术 | |
| D. | 大力开发新能源,如核能、太阳能、风能等,减少化石能源的使用 |
11.经测定,某溶液中只含有NH4+、Cl-、H+、OH-四种离子,下列说法中错误的是( )
| A. | 溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中的溶质是NH4Cl和NH3•H2O,则不等式c(NH4+)>c(Cl-)>c(NH3•H2O)>c(H+)一定正确 | |
| C. | 若溶液中四种离子满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl | |
| D. | 若溶液中c(Cl-)=c(NH4+),则该溶液呈中性 |
10.下列各组数据中,其比值为2:1的是( )
0 168946 168954 168960 168964 168970 168972 168976 168982 168984 168990 168996 169000 169002 169006 169012 169014 169020 169024 169026 169030 169032 169036 169038 169040 169041 169042 169044 169045 169046 169048 169050 169054 169056 169060 169062 169066 169072 169074 169080 169084 169086 169090 169096 169102 169104 169110 169114 169116 169122 169126 169132 169140 203614
| A. | 常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(S042-) | |
| B. | 相同温度下,0.2 mo I•L-1乙酸溶液与0.1 mo I•L-1乙酸溶液中,c(H+)之比 | |
| C. | Na2C03溶液中,c(Na+):c(C032-) | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
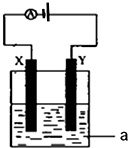 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C. CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.