20.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②还原性:HI>HBr>HCl
③熔沸点:SiO2>Na>NaCl>CO2 ④酸性:HNO3>H2CO3>HClO.
①热稳定性:H2O>HF>H2S ②还原性:HI>HBr>HCl
③熔沸点:SiO2>Na>NaCl>CO2 ④酸性:HNO3>H2CO3>HClO.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
19.能正确表示下列反应的离子方程式是( )
| A. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O═Cl-+SO42-+H+ |
18. 目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=566kJ•mol-1
③H2O(l)=H2O(g)△H=+44kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=_442.8kJ•mol-1
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除云(Co3+的还原产物是Co2+).
①写出阳极电极反应式Co2+-e-=Co3+;
②写出除云甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应.
②实验1中,以v(H2)表示的平均反应速率为0.16mol•(L•min)-1.
③900℃时,按CO(g)、H2O(g)、CO2(g)和H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)<v(逆)(填“>”“<”或“=”之一).
④实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强.
 目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=566kJ•mol-1
③H2O(l)=H2O(g)△H=+44kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=_442.8kJ•mol-1
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除云(Co3+的还原产物是Co2+).
①写出阳极电极反应式Co2+-e-=Co3+;
②写出除云甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验1中,以v(H2)表示的平均反应速率为0.16mol•(L•min)-1.
③900℃时,按CO(g)、H2O(g)、CO2(g)和H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)<v(逆)(填“>”“<”或“=”之一).
④实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强.
16.有M、X、Y、Z、W五种原子序数依次增大的短周期元素,其中M、Z同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A. | X、M两种元素形成的化合物只能存在离子键 | |
| B. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| C. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| D. | 元素W和M的某些单质可作为水处理中的消毒剂 |
12.以下物质间的每步转化中,有不能通过一步反应实现的是( )
0 168805 168813 168819 168823 168829 168831 168835 168841 168843 168849 168855 168859 168861 168865 168871 168873 168879 168883 168885 168889 168891 168895 168897 168899 168900 168901 168903 168904 168905 168907 168909 168913 168915 168919 168921 168925 168931 168933 168939 168943 168945 168949 168955 168961 168963 168969 168973 168975 168981 168985 168991 168999 203614
| A. | SO2→SO3→H2SO4 | B. | Al2O3→Al(OH)3→NaAlO2 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | CH2=CH2→CH3CH2OH→CH3CHO |
 )为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.
)为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.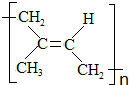 .
.

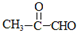 ;
; ;反应类型:酯化反应.
;反应类型:酯化反应. .
.
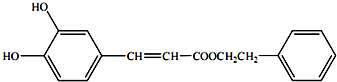
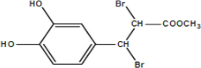
 (或
(或 、
、 )
) .
. (若有配位键,用箭号表示)
(若有配位键,用箭号表示)