题目内容
20.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S ②还原性:HI>HBr>HCl
③熔沸点:SiO2>Na>NaCl>CO2 ④酸性:HNO3>H2CO3>HClO.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
分析 ①元素的非金属性越强,其氢化物的稳定性越强;
②元素的非金属性越强,其氢化物的还原性越弱;
③晶体熔沸点:原子晶体>离子晶体>分子晶体;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:①元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>S,所以氢化物的稳定性HF>H2O>H2S,故错误;
②元素的非金属性越强,其氢化物的还原性越弱,非金属性Cl>Br>I,所以氢化物的还原性HI>HBr>HCl,故正确;
③晶体熔沸点:原子晶体>离子晶体>分子晶体,钠的熔沸点较低,所以熔沸点NaCl>Na,故错误;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>C,虽然Cl的非金属性较强,但HClO属于弱酸,所以酸性强弱HNO3>H2CO3>HClO,故正确;
故选D.
点评 本题考查元素周期律,侧重考查学生分析推断能力,知道非金属性强弱判断方法、晶体熔沸点高低判断方法,注意次氯酸是弱酸但属于强氧化性酸.

练习册系列答案
相关题目
10.根据下列操作及现象,所得结论正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 向2mL1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3 | Mg(OH)2转化为Fe(OH)3 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
11.下列关于有机物的叙述不正确的是( )
| A. | 煤、石油和天然气都是重要的化石燃料 | |
| B. | 蚕丝、塑料和橡胶均属于合成高分子材料 | |
| C. | 淀粉、麦芽糖和蛋白质均能发生水解反应 | |
| D. | 糖类、油脂和蛋白质都含有C、H、O三种元素 |
8.下列关于有机物的说法不正确是( )
| A. | 油脂是热值最高的营养物质 | |
| B. | 苯和乙醇都能发生氧化反应 | |
| C. | 聚乙烯能使酸性高锰酸钾溶液褪色 | |
| D. | 用Na2CO3溶液可以区分CH3COOH和CH3COOCH2CH3 |
5.2014年诺贝尔化学奖授予了美国及德国的三位化学家,以表彰他们为发展超分辨率荧光显微镜所作的贡献,开启了纳米微时代,这种开创性的成就使光学显微镜能够窥探纳米世界,可以观察类似病毒、蛋白质的微小结构,最小可分辨至2.0×10-8米,则下列说法不正确的是( )
| A. | 该技术可用于观察一些胶体粒子的运动 | |
| B. | 该技术可用于观察一些大分子蛋白质的合成 | |
| C. | 该技术使观察水的分子团簇结构成为可能 | |
| D. | 该技术可用于分辨荧光分子中各种不同种类的原子 |
12.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 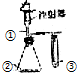 |
| A | 稀盐酸 | Na2SO4 | 溴水 | SO2具有漂白性 | |
| B | 浓氨水 | CaO | AlCl3溶液 | 白色沉淀生成后又溶解 | |
| C | 双氧水 | MnO2 | KI溶液 | 氧化性:O2>I2 | |
| D | 稀醋酸 | Na2CO3 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
 .
.