12.已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
| A. | A、B、D不可能在同周期 | B. | C和D的单质可能化合为离子化合物 | ||
| C. | A、D可能在同一主族 | D. | D一定在第二周期 |
10.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是( )
| A. | 等质量的金刚石与石墨完全燃烧,放出的能量一样多 | |
| B. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量少 | |
| C. | 石墨不如金刚石稳定 | |
| D. | 金刚石不如石墨稳定 |
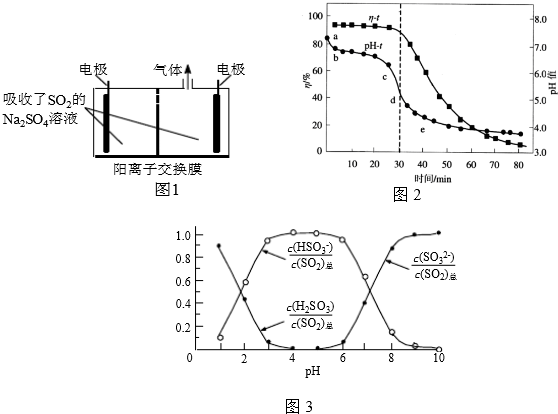
9. 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 增大体积 | C. | 升高温度 | D. | 加大X的投入量 |
8.一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器中各组分的体积分数不随时间变化容器内 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 3种气体AB、A2、B2共存 |
7.下列属于氧化还原反应,且又是吸热反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | |
| B. | 葡萄糖在人体内氧化分解 | |
| C. | 锌粒与稀H2SO4反应制取H2 | |
| D. | 二氧化碳与赤热的炭反应生成一氧化碳 |
6.下列关于铜-锌-稀硫酸构成的原电池的有关叙述,错误的是( )
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极 | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
5. 现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:
现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:
①向溶液中加入1~2滴指示剂.
②取20.00mL标准溶液放入锥形瓶中.
③用氢氧化钠溶液滴定至终点.
④重复以上操作.
⑤配制250mL盐酸标准溶液.
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的操作顺序是⑤②①③④⑥(填序号),上述②中使用的仪器除锥形瓶外,还需要酸式滴定管,使用酚酞作指示剂.
(2)滴定并记录V(NaOH)的初、终读数.数据记录如下表:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为
V(NaOH)=$\frac{19.98+20.00+20.80+20.02}{4}$mL=20.02mL
他的计算合理吗?不合理.理由是第3组数据明显偏大,不应采用.
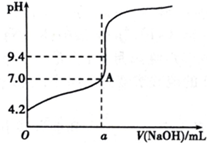
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如下图所示,则a< 20.02(填“>”“<”或“=”).
0 168766 168774 168780 168784 168790 168792 168796 168802 168804 168810 168816 168820 168822 168826 168832 168834 168840 168844 168846 168850 168852 168856 168858 168860 168861 168862 168864 168865 168866 168868 168870 168874 168876 168880 168882 168886 168892 168894 168900 168904 168906 168910 168916 168922 168924 168930 168934 168936 168942 168946 168952 168960 203614
 现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:
现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:①向溶液中加入1~2滴指示剂.
②取20.00mL标准溶液放入锥形瓶中.
③用氢氧化钠溶液滴定至终点.
④重复以上操作.
⑤配制250mL盐酸标准溶液.
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的操作顺序是⑤②①③④⑥(填序号),上述②中使用的仪器除锥形瓶外,还需要酸式滴定管,使用酚酞作指示剂.
(2)滴定并记录V(NaOH)的初、终读数.数据记录如下表:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(标准溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
V(NaOH)=$\frac{19.98+20.00+20.80+20.02}{4}$mL=20.02mL
他的计算合理吗?不合理.理由是第3组数据明显偏大,不应采用.
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如下图所示,则a< 20.02(填“>”“<”或“=”).