7.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,请写出该反应相应的离子方程式:ClO-+2H++Cl-=Cl2↑++H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是d(填字母编号).
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色,该现象不能(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是氯气具有强氧化性,过量的氯气能够将碘离子氧化成碘单质,离子方程式为:Cl2+2I-=I2+2Cl-(用必要的文字和离子方程式回答).
(5)此装置需要改进之处是:F原因是:氢氧化钙为微溶物,溶液中所含溶质较少,吸收氯气不充分,应改为氢氧化钠溶液吸收.

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,请写出该反应相应的离子方程式:ClO-+2H++Cl-=Cl2↑++H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是d(填字母编号).
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)此装置需要改进之处是:F原因是:氢氧化钙为微溶物,溶液中所含溶质较少,吸收氯气不充分,应改为氢氧化钠溶液吸收.
6.下列说法中,正确的是( )
| A. | 在元素周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 在元素周期表里,元素所在的周期序数等于原子核外电子层数 | |
| C. | 最外层电子数为8的粒子是稀有气体元素的原子 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
1.下列叙述正确的是( )
0 168450 168458 168464 168468 168474 168476 168480 168486 168488 168494 168500 168504 168506 168510 168516 168518 168524 168528 168530 168534 168536 168540 168542 168544 168545 168546 168548 168549 168550 168552 168554 168558 168560 168564 168566 168570 168576 168578 168584 168588 168590 168594 168600 168606 168608 168614 168618 168620 168626 168630 168636 168644 203614
| A. | 分子式为C3H6有机物最多存在4个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 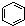 和 和 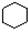 均是芳香烃, 均是芳香烃,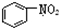 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| C. | 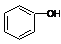 和 和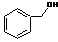 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此推测可能有H-O键 |
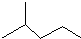 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.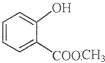 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. .
.
 .
.