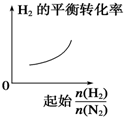
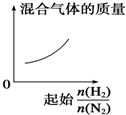
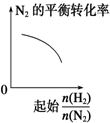
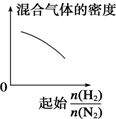
19.下列物质中能跟溴水、酸化高锰酸钾溶液、新制Cu(OH)2溶液、碳酸氢钠溶液都反应的是( )
| A. | CH2=CH2 | B. | C6H5OH | C. | 裂化汽油 | D. | 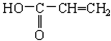 |
18.以下列分子式所表示的物质一定是纯净物的是( )
| A. | C2H5Cl | B. | C4H8 | C. | C6H6 | D. | C3H6O |
16.下列各组中两种微粒的半径(用r表示)之比小于1的是( )
| A. | $\frac{r(Na)}{r(N{a}^{+})}$ | B. | $\frac{r(S)}{r({S}^{2-})}$ | C. | $\frac{r(Mg)}{r(Al)}$ | D. | $\frac{r(Cl)}{r(F)}$ |
14. 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
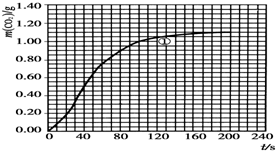
(2)实验①中CO2质量随时间变化的关系见图:
依据反应方程式$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O,计算实验①在70~90s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程).
 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格 (粗、细)对该反应速率 的影响. |
| ② | ||||
| ③ | ||||
| ④ |
依据反应方程式$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O,计算实验①在70~90s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程).
12. 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的( )
 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的( )| A. | a、c两点的反应速率:a>c | |
| B. | a、c两点气体的颜色:a深,c浅 | |
| C. | b、c两点的平衡常数:b<c | |
| D. | a、c两点气体的平均相对分子质量:a>c |
10.下列有关中和热的说法正确的是( )
0 168400 168408 168414 168418 168424 168426 168430 168436 168438 168444 168450 168454 168456 168460 168466 168468 168474 168478 168480 168484 168486 168490 168492 168494 168495 168496 168498 168499 168500 168502 168504 168508 168510 168514 168516 168520 168526 168528 168534 168538 168540 168544 168550 168556 168558 168564 168568 168570 168576 168580 168586 168594 203614
| A. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| B. | 准确测量中和热的实验过程中,至少需测定温度4次 | |
| C. | 表示中和热的热化学方程式:H+(l)+OH-(l)═H2O(l)△H=-57.3 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |

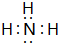 ;
; 一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:
一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应: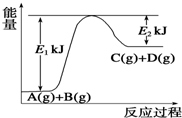 已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.