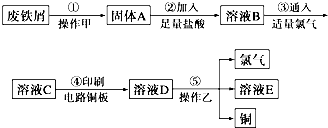
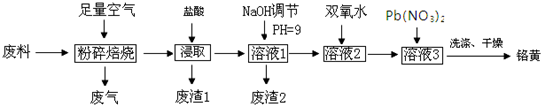
14.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | 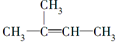 +Br2(CCl4)→ +Br2(CCl4)→ | |
| B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | CH4+Cl2$\stackrel{光照}{→}$ |
13.下列说法不正确的是( )
| A. | 最外层电子数为次外层电子数一半的短周期主族元素只有Li、Si两种元素 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间10个纵行的元素都是金属元素 | |
| C. | 同周期第ⅡA族与第ⅢA族元素的原子序数相差1或11或25 | |
| D. | 若主族元素的族序数为a,周期数为b,当$\frac{a}{b}$<1,该元素为非金属元素 |
12.下列关于有机物的命名中正确的是( )
| A. | 2─二甲基戊烷 | B. | 2─乙基戊烷 | C. | 3,4─二甲基戊烷 | D. | 3─甲基己烷 |
11.一定温度下,在三个体积约为2.0L的恒容密闭容器中发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)
回答下列问题:
(1)反应的△H小于0(填“大于”或“小于”)判断的理由是反应Ⅰ、Ⅲ起始量相同,Ⅰ的CH3OCH3(g)含量低,说明降温正向移动,正反应为放热过程△H<0,容器Ⅰ到达平衡所需的时间为20min反应速率v(CH2OH)为0.004mol•L-1•min-1,列式求算387℃时该反应的平衡常数K1=4
(2)容器Ⅱ达平衡时,压强是容器Ⅰ的两倍,CH3OH的体积分数和容器Ⅰ中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OCH3(g)的体积分数为0.4
(3)t分钟后容器Ⅲ达到平衡,t大于20min(填“大于”、“等于”或“小于”)判断的理由是温度越低,反应速率越小,达到平衡时所需的时间越长请在图中分别画出容器Ⅰ和容器Ⅱ中CH3OH(g)浓度变化的曲线示意图

(4)208℃,若向3L容器中充入0.9molCH3OH(g),0.6molCH3OCH3(g)和0.3molH2O(g),则起始时该反应的v正>v逆(填“>”“<”或“=”)
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | |||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
(1)反应的△H小于0(填“大于”或“小于”)判断的理由是反应Ⅰ、Ⅲ起始量相同,Ⅰ的CH3OCH3(g)含量低,说明降温正向移动,正反应为放热过程△H<0,容器Ⅰ到达平衡所需的时间为20min反应速率v(CH2OH)为0.004mol•L-1•min-1,列式求算387℃时该反应的平衡常数K1=4
(2)容器Ⅱ达平衡时,压强是容器Ⅰ的两倍,CH3OH的体积分数和容器Ⅰ中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OCH3(g)的体积分数为0.4
(3)t分钟后容器Ⅲ达到平衡,t大于20min(填“大于”、“等于”或“小于”)判断的理由是温度越低,反应速率越小,达到平衡时所需的时间越长请在图中分别画出容器Ⅰ和容器Ⅱ中CH3OH(g)浓度变化的曲线示意图

(4)208℃,若向3L容器中充入0.9molCH3OH(g),0.6molCH3OCH3(g)和0.3molH2O(g),则起始时该反应的v正>v逆(填“>”“<”或“=”)
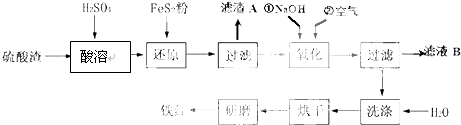
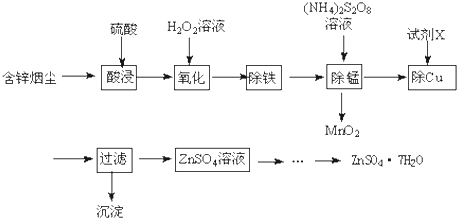
5.将“废杂铜烟尘”用硫酸吸收浸取,既可保护环境又可得到用途广泛的高纯硫酸锌.已知烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO.制备工艺流程如图:
(1)硫酸锌溶液滴入石蕊试液,溶液变红,其原因是Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+.
(2)H2O2氧化Fe2+的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)“除铁”时,溶液的pH应调整到3.2~5.2(相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH,金属离子开始沉淀时的浓度为1mol•L-1).
(4)“除锰”时溶液中发生反应的化学方程式为MnSO4+(NH4)2S2O8+2H2O=MnO2↓+(NH4)2SO4+2H2SO4或MnSO4+(NH4)2S2O8+2H2O=MnO2↓+2NH4HSO4+H2SO4.
(5)试剂X为Zn粉.
(6)由ZnSO4溶液需经过:蒸发浓缩、冷却结晶、过滤及干燥得ZnSO4•7H2O.
0 168359 168367 168373 168377 168383 168385 168389 168395 168397 168403 168409 168413 168415 168419 168425 168427 168433 168437 168439 168443 168445 168449 168451 168453 168454 168455 168457 168458 168459 168461 168463 168467 168469 168473 168475 168479 168485 168487 168493 168497 168499 168503 168509 168515 168517 168523 168527 168529 168535 168539 168545 168553 203614
(1)硫酸锌溶液滴入石蕊试液,溶液变红,其原因是Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+.
(2)H2O2氧化Fe2+的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)“除铁”时,溶液的pH应调整到3.2~5.2(相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH,金属离子开始沉淀时的浓度为1mol•L-1).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
(5)试剂X为Zn粉.
(6)由ZnSO4溶液需经过:蒸发浓缩、冷却结晶、过滤及干燥得ZnSO4•7H2O.


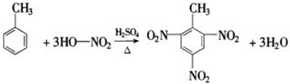

 -CH2CH3+18KMnO4+27H2SO4→5HOOC-
-CH2CH3+18KMnO4+27H2SO4→5HOOC- -COOH+9K2SO4+18MnSO4+5CO2↑+42H2O
-COOH+9K2SO4+18MnSO4+5CO2↑+42H2O