12.分子式为C5H12O的有机物可以与Na反应放出H2,则其同分异构体中,含有三个甲基的有机物共有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
10.哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下发生反应:N2+3H2?2NH3.下列有关说法不正确的是( )
| A. | 若2分钟达到化学平衡时N2还剩下0.4mol,则v(N2)=0.3mol/(L•min) | |
| B. | 达到化学平衡时,单位时间内每生成0.1mol的H2同时生成0.1mol的NH3 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡后,若增大压强使容器体积缩小,化学反应速率将会增大 |
9.一种燃料电池,以镍板为电极插入KOH溶液,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+$\frac{7}{2}$O2+14e-=14OH-.有关推断不正确的是( )
| A. | 通氧气的电极为负极 | |
| B. | 参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | 电池工作一段时间后,KOH的物质的量浓度减小 | |
| D. | 电池工作时,溶液中OH-离子向正极移动 |
8.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )
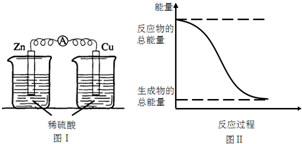

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 图II所示的反应为吸热反应 |
7.下列各组微粒半径的排列顺序正确的是( )
| A. | Na<Si<P | B. | O2->Mg2+>Al3+ | C. | Ca>Ba>Ca2+ | D. | Cl->F>F- |
6.下列关于元素周期表和元素周期律的说法不正确的是( )
| A. | 从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强 | |
| C. | 第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| D. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 |
5.下列变化中,不需要破坏化学键的是( )
| A. | 加热碳酸氢钠 | B. | 氯化氢溶于水 | C. | 食盐熔化 | D. | 干冰气化 |
4.下列关于有机化合物的说法正确的是( )
| A. | 煤的液化过程为物理过程 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 酸性高锰酸钾可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
3.在光照条件下,CH4与Cl2能发生取代反应.若将1mol CH4与Cl2反应,待反应完成后测得四种有机取代物的物质的量之比为n(CH3Cl):n(CH2Cl2):n(CHCl3):n(CCl4)=1:2:3:4,则消耗的Cl2为( )
0 168075 168083 168089 168093 168099 168101 168105 168111 168113 168119 168125 168129 168131 168135 168141 168143 168149 168153 168155 168159 168161 168165 168167 168169 168170 168171 168173 168174 168175 168177 168179 168183 168185 168189 168191 168195 168201 168203 168209 168213 168215 168219 168225 168231 168233 168239 168243 168245 168251 168255 168261 168269 203614
| A. | 1.0 mol | B. | 2.0 mol | C. | 3.0 mol | D. | 4.0 mol |

 .
.