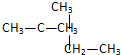6.下列各对物质,互为同系物的是( )
| A. | CH3-CH═CH2与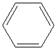 | B. | 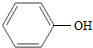 与 与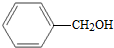 | ||
| C. | CH3COOCH3与CH3CH2COOCH3 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
5.某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
提示:KSCN中S元素的化合价为-2价
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
③查阅资料得知:Cl-对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是分别取2mL0.1mol/LFeCl3溶液和2mL 0.05mol/L Fe2(SO4)3溶液,分别滴入KSCN溶液,溶液均变为红色;再分别加入等浓度等体积的H2O2溶液,FeCl3溶液褪色快(或取0.05mol/L Fe2(SO4)3溶液,滴入KSCN溶液,溶液变红色,将红色溶液分为2份,1份加入NaCl固体,另一份不变,向这两份溶液中均加入等浓度等体积的H2O2溶液,加入NaCl的溶液红色迅速褪色).
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2, 无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
③查阅资料得知:Cl-对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是分别取2mL0.1mol/LFeCl3溶液和2mL 0.05mol/L Fe2(SO4)3溶液,分别滴入KSCN溶液,溶液均变为红色;再分别加入等浓度等体积的H2O2溶液,FeCl3溶液褪色快(或取0.05mol/L Fe2(SO4)3溶液,滴入KSCN溶液,溶液变红色,将红色溶液分为2份,1份加入NaCl固体,另一份不变,向这两份溶液中均加入等浓度等体积的H2O2溶液,加入NaCl的溶液红色迅速褪色).
3.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应过程中测定的部分数据如表:
下列说法正确的是( )
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol |
2. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O |
1.下列解释事实的化学方程式不正确的是( )
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3$N{{H}_{4}}^{+}$ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
20.化学与生产、生活密切相关.下列叙述正确的是( )
0 167978 167986 167992 167996 168002 168004 168008 168014 168016 168022 168028 168032 168034 168038 168044 168046 168052 168056 168058 168062 168064 168068 168070 168072 168073 168074 168076 168077 168078 168080 168082 168086 168088 168092 168094 168098 168104 168106 168112 168116 168118 168122 168128 168134 168136 168142 168146 168148 168154 168158 168164 168172 203614
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
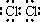 .
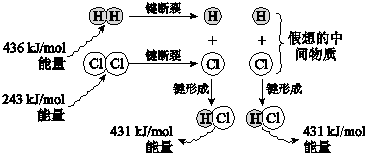
.
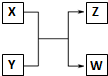 已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:
已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题: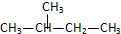 和
和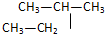
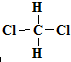 和
和
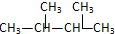 和
和