9.下列各组离子一定能大量共存的是( )
| A. | 强酸性溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 强碱溶液中:Na+、K+、[Al(OH)4]-、CO32- | |
| C. | 强碱性溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
8.下列说法正确的是( )
| A. | 所含质子数和电子数相等的微粒一定是原子 | |
| B. | 两种微粒如果核外电子排布相同,化学性质就一定相同 | |
| C. | 质量数相同的原子其化学性质一定相同 | |
| D. | 具有相同核电荷数的原子或单核离子一定是同种元素 |
7.FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学研究小组为探究在酒精喷灯加热条件下FeSO4分解的气体产物,进行了一系列实验.已知SO3的熔点是16.8℃,沸点是44.8℃.
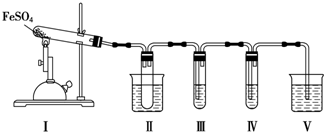
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
(3)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄.
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.

请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.
5.W、X、Y、Z是元素周期表中前四周期的四种元素,它们的原子序数依次递增.请结合下表中的信息,回答下列问题:
(1)W的第一电离能大于其同周期相邻的元素的原因是氮元素的原子核外2p能级的电子排布处于半满状态比较稳定;Z3+的M层电子数为13.
(2)W、X、Y三种元素的简单离子半径的大小关系是C1->N3->Al3+ (请用离子符号表示).
(3)Y的气态氢化物的沸点是同族元素形成的气态氢化物中最低 (填“高”或“低”);XW晶体与金刚石类似,与同一个W原子相连的X原子构成的空间构型为正四面体形.
(4)在25℃、101 kPa下,Z的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出Q kJ的热量,则Z单质燃烧的热化学方程式为3Fe(s)+2O2(g)═Fe3O4(s)△H=-8QkJ•mol-1 .
(5)在一定条件下,利用W的氢化物可使空气污染物之一的WO2转化为参与大气循环的物质.请写出一个符合上述条件的反应方程:6NO2+8NH3=7N2+12H2O.
| W | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| X | 常见的金属,在周期表中的周期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 其原子质量数为56,中子数为30的核素 |
(2)W、X、Y三种元素的简单离子半径的大小关系是C1->N3->Al3+ (请用离子符号表示).
(3)Y的气态氢化物的沸点是同族元素形成的气态氢化物中最低 (填“高”或“低”);XW晶体与金刚石类似,与同一个W原子相连的X原子构成的空间构型为正四面体形.
(4)在25℃、101 kPa下,Z的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出Q kJ的热量,则Z单质燃烧的热化学方程式为3Fe(s)+2O2(g)═Fe3O4(s)△H=-8QkJ•mol-1 .
(5)在一定条件下,利用W的氢化物可使空气污染物之一的WO2转化为参与大气循环的物质.请写出一个符合上述条件的反应方程:6NO2+8NH3=7N2+12H2O.
4.室温条件下,下列有关溶液中粒子浓度的关系式中,正确的是( )


| A. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| B. | pH相同的①CH3COONa、②NaHCO3、③ 三份溶液中的c(Na+):③>②>① 三份溶液中的c(Na+):③>②>① | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 图中V(CH3COOH)>20mL,溶液pH<7 |
3.已知弱酸的电离平衡常数如下表:下列选项正确的是( )
| 弱酸 | H2CO3 | 水杨酸(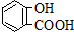 ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于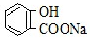 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和 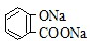 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→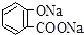 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
2.仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )
0 167933 167941 167947 167951 167957 167959 167963 167969 167971 167977 167983 167987 167989 167993 167999 168001 168007 168011 168013 168017 168019 168023 168025 168027 168028 168029 168031 168032 168033 168035 168037 168041 168043 168047 168049 168053 168059 168061 168067 168071 168073 168077 168083 168089 168091 168097 168101 168103 168109 168113 168119 168127 203614
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管、烧杯 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、玻璃棒、温度计 |
| D | 分离苯和苯酚的混合物 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | .D |

 .
.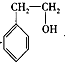 +CH3COOH$?_{△}^{浓硫酸}$
+CH3COOH$?_{△}^{浓硫酸}$ +H2O.
+H2O. 、、
、、 、
、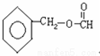 .
.
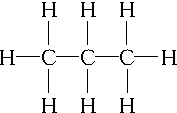 ,C3H6的同分异构体为CH2═CH-CH3、
,C3H6的同分异构体为CH2═CH-CH3、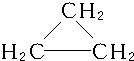 .
.