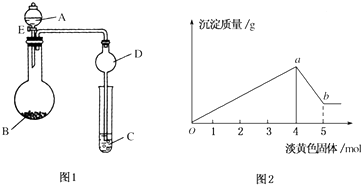
题目内容
2.仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管、烧杯 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、玻璃棒、温度计 |
| D | 分离苯和苯酚的混合物 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | .D |
分析 A.碳酸氢钠不稳定,加热易分解;
B.应用固体干燥剂;
C.应该用强酸与强碱反应测中和热;
D.苯与苯酚互溶.
解答 解:A.碳酸氢钠不稳定,可在试管中加热,故A正确;
B.洗气瓶盛装液态物质,固体干燥剂碱石灰应放在干燥管中,故B错误;
C.醋酸为弱酸,电离吸热,应该用强酸与强碱反应测中和热,故C错误;
D.苯与苯酚互溶,不能用分液法分离,可用蒸馏的方法分离,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的分离、中和热的测定等,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意实验方案的严密性和可行性的评价,难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
12.下列反应一定能自发进行的是( )
| A. | 放热反应 | B. | 熵增加的反应 | ||
| C. | 熵增加的吸热反应 | D. | 熵增加的放热反应 |
13.下列说法正确的是( )
| A. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
10.下列化合物分别跟溴在铁粉作催化剂的条件下反应,苯环上的氢原子被取代,所得一溴代物有三种同分异构体的是( )
①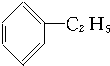 ②
②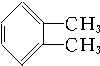 ③
③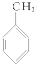 ④
④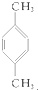
①
 ②
② ③
③ ④
④
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
17.下面是有关弱酸的电离平衡常数.结合数据,分析下列有关说法,其中错误的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1 mol•L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | 升高温度,HCN溶液中H+浓度增大,平衡正向移动,电离平衡常数增大 | |
| C. | 向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的电离平衡都正向移动 | |
| D. | 向CH3COOH溶液中加入少量氢氧化钠固体,平衡正向移动 |
7.FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学研究小组为探究在酒精喷灯加热条件下FeSO4分解的气体产物,进行了一系列实验.已知SO3的熔点是16.8℃,沸点是44.8℃.
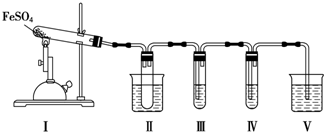
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
(3)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄.
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.

请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.
12.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| B. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| C. | 高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |