18.下表是3种物质的溶解度(20℃),下列说法正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将表中三种物质分别与水混合,分别加热、灼烧,最终的固体产物相同 | |
| D. | 用足量石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
17.下列有关实验的叙述正确的是( )
| A. | 除去(NH4)2CO3溶液中含有的少量NH4HCO3杂质的方法是加入NaOH溶液 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中不能得到纯净的氯气 | |
| C. | 向两份Fe2O3的固体中分别加入HCl溶液与HI溶液,二者反应现象相同 | |
| D. | 向固体中加入足量的浓HNO3加热,能得到使澄清石灰水变浑浊的气体,证明该固体中一定存在CO32-或HCO3- |
14.设m为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 14gC2H4中含有2m个C-H键 | |
| B. | 1mol.L-1 NH3•H2O溶液中含有nA个NH4+ | |
| C. | 1molNa2O2和足量CO2反应产生nA个O2分子 | |
| D. | 常温常压下,22.4L的SO2中含有nA个SO2分子 |
13.在2014年国家科学技术奖励大会上,甲醇制取低碳烯烃技术(DMTO)获国家技术发明奖一等奖.DMTO主要包括煤的气化、液化、烯烃化三个阶段.
(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
①a<0(填“>”、“<”、“=”),c与a、b之间的定量关系为c=a+b.
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).

①为尽可能多地获得乙烯,控制的生产条件为530℃、0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)在压强为P1 时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图.
(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).

①为尽可能多地获得乙烯,控制的生产条件为530℃、0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)在压强为P1 时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图.
12.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
0 167472 167480 167486 167490 167496 167498 167502 167508 167510 167516 167522 167526 167528 167532 167538 167540 167546 167550 167552 167556 167558 167562 167564 167566 167567 167568 167570 167571 167572 167574 167576 167580 167582 167586 167588 167592 167598 167600 167606 167610 167612 167616 167622 167628 167630 167636 167640 167642 167648 167652 167658 167666 203614
| A. | CO和 N2为等电子体,22.4L的CO气体和1mol N2所含的电子数相等 | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 在标准状况下,30g福尔马林和22.4L三氧化硫所含氧原子数之比为1:3 |


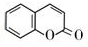

 的化学方程式(无机试剂任选)
的化学方程式(无机试剂任选)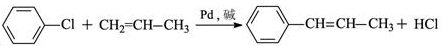 、
、 .
. 甲烷、甲醇、CO、H2、CO2均是重要的化工原料.
甲烷、甲醇、CO、H2、CO2均是重要的化工原料. 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.


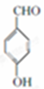
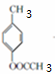 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$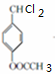 +2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH
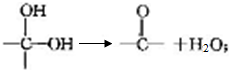
+2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH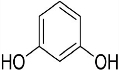 +CH3COOH$\stackrel{催化剂}{→}$
+CH3COOH$\stackrel{催化剂}{→}$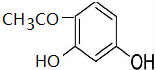 +H2O
+H2O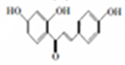
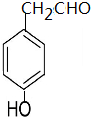 (填结构简式)
(填结构简式)