题目内容
11. 甲烷、甲醇、CO、H2、CO2均是重要的化工原料.
甲烷、甲醇、CO、H2、CO2均是重要的化工原料.(1)将天然气、CO2、H2O按适当比例混合后发生反应,只得到一种产物甲醇,该反应的化学方程式为CO2+2H2O+3CH4=4CH3OH
(2)已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△∥=-242kJ•mol-1
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△∥=-802kJ•mol-1
③CH4(g)+H2O(g)?CO(g)+3H2(g)△∥=+206kJ•mol-1
则CO的燃烧热△H为-282KJ/mol
(3)在一定温度下,将2mol的CH4和2mol的H2O(g)充入2L恒温密闭容器中,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),反应过程中容器内CO的浓度随时间变化如图所示:
①反应从开始到恰好达到第一次平衡时v(H2)=0.075mol/(L•min)该温度下的平衡常数K=6.75
②26s时改变的条件可能是增大了反应物的浓度下列能表示该反应达到平衡状态的标志是d(填序号).
a.消耗CH4、H2的速率比为3:1
b.v(CO)生成=v(CH4)消耗
c.混合气体的密度不变
d.混合气体的平均相对分子质量不变
(4)利用电解的原理可将CO2转化为CH4(电解质溶液为KOH溶液),则阴极上的电极反应式为CO2+8e-+6H2O=8OH-+CH4,电解总反应为CO2+2H2O$\frac{\underline{\;通电\;}}{\;}$CH4+2O2.
分析 (1)将天然气、CO2、H2O按适当比例混合后发生反应,只得到一种产物甲醇,结合原则守恒配平书写化学方程式;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(3)①图象分析可知第一次平衡时c(CO)=0.50mol/L,结合化学平衡三段式列式计算
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 1 1 0 0
变化量(mol/L) 0.5 0.5 0.5 1.5
平衡量(mol/L) 0.5 0.5 0.5 1.5
依据反应速率v=$\frac{△c}{△t}$计算得到,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②图象可知,26s时一氧化碳的浓度一直增大到第二次平衡,说明平衡正向进行,所以改变的条件可能增大了反应物的浓度;平衡标志是正逆反应速率相同,各组分含量保持不变,分析选项中变量不变分析判断;
(4)利用电解的原理可将CO2转化为CH4(电解质溶液为KOH溶液),则阴极上是二氧化碳得到电子发生还原反应生成甲烷,据此书写电极反应式,电池反应是通电条件下二氧化碳和水反应生成甲烷和氧气.
解答 解:(1)将天然气、CO2、H2O按适当比例混合后发生反应,只得到一种产物甲醇,结合原则守恒配平书写化学方程式为:CO2+2H2O+3CH4=4CH3OH;
故答案为:CO2+2H2O+3CH4=4CH3OH;
(2)①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ•mol-1
③CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ•mol-1
依据盖斯定律②-③-①×3得到CO的燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol
△H为282KJ/mol
故答案为:-282KJ/mol;
(3)①图象分析可知第一次平衡时c(CO)=0.50mol/L,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 1 1 0 0
变化量(mol/L) 0.5 0.5 0.5 1.5
平衡量(mol/L) 0.5 0.5 0.5 1.5
依据反应速率概念计算v(H2)=$\frac{△c}{△t}$=$\frac{1.5mol/L}{20min}$=0.075mol/(L•min),
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{0.5×1.{5}^{3}}{0.5×0.5}$=6.75;
故答案为:0.075mol/(L•min);6.75;
②图象可知,26s时一氧化碳的浓度一直增大到第二次平衡,说明平衡正向进行,所以改变的条件可能增大了反应物的浓度;平衡标志是正逆反应速率相同,各组分含量保持不变,
a.消耗CH4、H2的速率比为1:3时,说明正逆反应速率相同,故a错误;
b.v(CO)生成=v(CH4)消耗,只能说明反应正向进行,不能说明反应达到平衡状态,故b错误;
c.反应前后气体质量不变,容器体积不变,过程中混合气体的密度始终不变,密度不变不能说明反应达到平衡状态,故c错误;
d.反应前后气体物质的量变化,气体质量不变,混合气体的平均相对分子质量不变说明反应达到平衡状态,故d正确;
故答案为:d;
(4)利用电解的原理可将CO2转化为CH4(电解质溶液为KOH溶液),则阴极上是二氧化碳得到电子发生还原反应生成甲烷,据此书写电极反应式为:CO2+8e-+6H2O=8OH-+CH4,阳极上是溶液中氢氧根离子失电子生成氧气,电池反应是通电条件下二氧化碳和水反应生成甲烷和氧气,反应的化学方程式为:CO2+2H2O$\frac{\underline{\;通电\;}}{\;}$CH4+2O2;
故答案为:CO2+8e-+6H2O=8OH-+CH4;CO2+2H2O$\frac{\underline{\;通电\;}}{\;}$CH4+2O2.
点评 本题考查了热化学方程式书写,化学平衡的计算应用,反应速率、平衡常数、转化率等概念的计算分析,影响反应速率和平衡的因素判断,电解原理的理解应用,掌握平衡移动原理和化学基础是解题关键,题目难度中等.

| A. | 石油是混合物,其分馏产品汽油是纯净物 | |
| B. | 焰色反应有特征颜色出现,所以是化学反应 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 大量化石燃料是造成雾霾天气的一种重要因素 |
| A. | 丁学生:在醋酸钠溶液中滴入酚酞溶液,加热后若红色加深,说明盐类水解是吸热的 | |
| B. | 甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 乙学生:在盐酸中加入同温度的氨水,若混合液温度下降,说明盐类水解是吸热的 | |
| D. | 丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 |
①C2H4 ②H2C═C═O(乙烯酮) ③CH3CHO ④CH3COOH.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
①
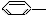 CH3 ②
CH3 ②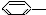 CH=CH2
CH=CH2 ③
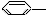 NO2 ④
NO2 ④ OH
OH ⑤
 ⑥
⑥ CH-(CH3)2.
CH-(CH3)2.| A. | ③④ | B. | ②⑤ | C. | ①⑥ | D. | ①②⑤⑥ |
| W | X | R | |
| Y | Z |
| A. | 粒子半径:原子半径最大的是W,简单阴离子半径最小的是R | |
| B. | 单质:氧化性最强的是Z,还原性最强的是Y | |
| C. | 最高价氧化物对应水化物:酸性最强的是Z,水溶性最差的是Y | |
| D. | 最简单氢化物:沸点最高的是X,稳定性最差的是W |
| A. | KMnO4溶液 | B. | H2O2溶液 | C. | 氯水 | D. | HNO3溶液 |