16.下列物质在给定条件下同分异构体数目正确的是( )
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 结构为 的一溴代物有5种 的一溴代物有5种 |
15.下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
| A. | C5H10和C6H6 | B. | C2H6和C2H4O2 | C. | C3H6和C3H8 | D. | C2H6和C3H8 |
14.短周期元素X、Y、Z、W、Q原子序数逐渐增大,X的氢化物极易溶于Y的氢化物,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.由此得出的正确结论是( )
| A. | 元素Y的最高正价是+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 元素X的最高价氧化物对应水化物的酸性比Q的强 | |
| D. | 氢化物的沸点Y>W |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,32g O2和16g O3的混合物中,含有O原子数目为2NA | |
| B. | 标准状况下,1mol Na2O 和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为 $\frac{2}{3}$NA |
11.短周期元素A、B、C、D、E的原子序数依次增大,A的一种核素的质量数为1,A和B同主族,C原子的最外层电子数是其电子层数的3倍,D的最高正价与最低负价的绝对值相等,E的最高价氧化物的水化物的化学式为HnEO2n+2.下列说法正确的是( )
| A. | A+离子半径小于B+离子半径 | |
| B. | B是其所在主族元素中金属性最强的 | |
| C. | D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | |
| D. | D与E组成的化合物中,各原子最外层均达到8电子结构 |
10.下列说法正确的是( )
| A. | 配制1.001.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| B. | 在50mL量筒中配制0.100 0moL•L-1碳酸钠溶液 | |
| C. | 只有100mL容量瓶、烧杯、玻璃棒、胶头滴管(非玻璃仪器任选),用pH=1的盐酸无法配制100mLpH=2的盐酸 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
9.分子式为C5H10O2,既可与金属反应放出氢气又能发生银镜反应的有机化合物有(不考虑立体异构)( )
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 14种 |
8. 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.
(1)Y原子核外共有7种不同运动状态的电子,T原子的价层电子排列式3d104s1.
(2)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp.
(3)Z 与R能形成化合物甲,1mol甲中含4mol共价键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形、V形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
(5)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++2 NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
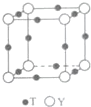
(6)T与Y形成的晶体的晶胞结构如图所示,Y离子的配位数是6..设晶胞棱长为acm,密度为 bg•cm-3,则阿伏伽德罗常数可表示为$\frac{206}{b{a}^{3}}$(用含a、b的式子表示)
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.(1)Y原子核外共有7种不同运动状态的电子,T原子的价层电子排列式3d104s1.
(2)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp.
(3)Z 与R能形成化合物甲,1mol甲中含4mol共价键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形、V形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)T与Y形成的晶体的晶胞结构如图所示,Y离子的配位数是6..设晶胞棱长为acm,密度为 bg•cm-3,则阿伏伽德罗常数可表示为$\frac{206}{b{a}^{3}}$(用含a、b的式子表示)
7.向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是( )
0 167459 167467 167473 167477 167483 167485 167489 167495 167497 167503 167509 167513 167515 167519 167525 167527 167533 167537 167539 167543 167545 167549 167551 167553 167554 167555 167557 167558 167559 167561 167563 167567 167569 167573 167575 167579 167585 167587 167593 167597 167599 167603 167609 167615 167617 167623 167627 167629 167635 167639 167645 167653 203614
| A. | 硝酸亚铁溶液中加入稀硫酸 | |
| B. | 含有酚酞的碳酸钠溶液中加入足量的氧化钙溶液 | |
| C. | 硫酸铜溶液中滴加硝酸钡溶液 | |
| D. | 高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |