17.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 铝粉与盐酸的反应 | D. | 氧化钙溶于水 |
16.原子结构为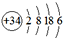 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )
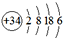 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )| A. | 第六周期第Ⅳ族 | B. | 第四周期第Ⅵ族 | C. | 第六周期第ⅣA族 | D. | 第四周期第ⅥA族 |
15.关于元素周期表中元素分布的描述,正确的是( )
| A. | 周期表中的主族都有非金属元素 | |
| B. | 周期表中的主族都有金属元素 | |
| C. | 周期表中的金属元素都位于长周期 | |
| D. | 周期表中的非金属元素都位于主族和0族 |
14.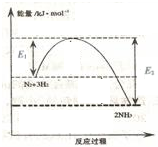 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
(1)如图表示一定温度和压强下氨气和氢气合成氨反应过程中的能量变化,则合成氨反应为放热(填“吸热”或“放热”)反应.
(2)在一定温度下,在2L密闭容器中加入催化剂并通入0.1molNH3(g),发生反应:2NH3?N2+3H2,不同时间产生N2的物质的量见下表:
①前20min内,H2的反应速率为1.2×10-3mol/(L.min).
②达到平衡后,容器中c(NH3)═0.01mol/L.
③若在1L密闭容器中加入催化剂并通入0.1mol NH3(g),则容器中的反应速率比原容器的快(填“快”或“慢”).
 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.(1)如图表示一定温度和压强下氨气和氢气合成氨反应过程中的能量变化,则合成氨反应为放热(填“吸热”或“放热”)反应.
(2)在一定温度下,在2L密闭容器中加入催化剂并通入0.1molNH3(g),发生反应:2NH3?N2+3H2,不同时间产生N2的物质的量见下表:
| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
②达到平衡后,容器中c(NH3)═0.01mol/L.
③若在1L密闭容器中加入催化剂并通入0.1mol NH3(g),则容器中的反应速率比原容器的快(填“快”或“慢”).
12.四种常见元素的相关信息如下表所示,请回答下列问题:
(1)W的基态原子的价电子排布式为4s24p3,Z、W两种元素的第一电离能的大小关系为Cl>As(用元素符号表示).
(2)Z能与X、Y、W形成XZ4、YZ3、WZ3、WZ5等化合物,其中中心原子杂化方式为sp3的分子是CCl4、NCl3、AsCl3(填化学式,下同),分子构型为正四面体的是CCl4.
(3)Y、Z及氢、铂元素可组成为Pt(YH3)2Z2的配合物,该配合物存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”).
②P分子的结构简式为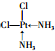 (YH3作为一个整体写)
(YH3作为一个整体写)
(4)X的一种单质分子(N)的球棍模型如图1所示,该分子中每个X原子均形成了稳定的8电子结构,则分子中σ键与π键数目之比为3:1.一定条件下含NA个X原子的N与足量氢气发生加成反应时,消耗1gH2
(5)W与镓的化合物(GaW)是一种半导体材料,其晶胞结构如图2所示,镓原子的配位数是4,该晶胞的密度为ρg•cm-3,则该晶胞的边长为$\root{3}{\frac{580}{ρ•{N}_{A}}}$cm(用含NA、ρ的代数式表示).

图1 图2.
| 元素 | X | Y | Z | W |
| 相关信息 | 短周期p区元素,有种单质常作电极材料 | 基态原子2p能级上各轨道中均有电子且电子的自旋方向相同 | 基态原子的核外电子共有17种运动状态 | 位于第四周期第VA族 |
(2)Z能与X、Y、W形成XZ4、YZ3、WZ3、WZ5等化合物,其中中心原子杂化方式为sp3的分子是CCl4、NCl3、AsCl3(填化学式,下同),分子构型为正四面体的是CCl4.
(3)Y、Z及氢、铂元素可组成为Pt(YH3)2Z2的配合物,该配合物存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”).
②P分子的结构简式为
 (YH3作为一个整体写)
(YH3作为一个整体写)(4)X的一种单质分子(N)的球棍模型如图1所示,该分子中每个X原子均形成了稳定的8电子结构,则分子中σ键与π键数目之比为3:1.一定条件下含NA个X原子的N与足量氢气发生加成反应时,消耗1gH2
(5)W与镓的化合物(GaW)是一种半导体材料,其晶胞结构如图2所示,镓原子的配位数是4,该晶胞的密度为ρg•cm-3,则该晶胞的边长为$\root{3}{\frac{580}{ρ•{N}_{A}}}$cm(用含NA、ρ的代数式表示).

图1 图2.
10.研究PM2.5、SO2、NO2等大气污染物具有重要意义,请回答下列问题:
(1)PM2.5常吸附含有砷的化合物等有毒致癌物质,砷的元素符号为As,位于元素周期表第四周期第ⅤA族.
(2)将PM2.5样本用蒸馏水处理成待测液,测得所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待浊溶液的pH=4.
(3)室温下,用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化如下表:
由上表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在:HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
(4)已知:2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
一定条件下,将NO和SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变 c.SO3和NO的体积保持不变 d.每消耗1molSO3的同时生成1molNO2.
(1)PM2.5常吸附含有砷的化合物等有毒致癌物质,砷的元素符号为As,位于元素周期表第四周期第ⅤA族.
(2)将PM2.5样本用蒸馏水处理成待测液,测得所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)室温下,用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化如下表:
| N(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知:2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
一定条件下,将NO和SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变 c.SO3和NO的体积保持不变 d.每消耗1molSO3的同时生成1molNO2.
9.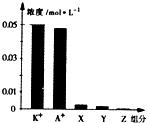 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
0 167325 167333 167339 167343 167349 167351 167355 167361 167363 167369 167375 167379 167381 167385 167391 167393 167399 167403 167405 167409 167411 167415 167417 167419 167420 167421 167423 167424 167425 167427 167429 167433 167435 167439 167441 167445 167451 167453 167459 167463 167465 167469 167475 167481 167483 167489 167493 167495 167501 167505 167511 167519 203614
 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | 该混合溶液pH=7.0 | B. | 原HA溶液中:c(HA)>c(H+)>c(A-) | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 混合溶液中:c(X)+x(A-)=c(K+) |
 )广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线:
)广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线: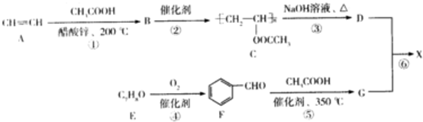

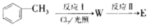
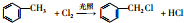 ,反应Ⅱ的试剂为氢氧化钠水溶液、加热.
,反应Ⅱ的试剂为氢氧化钠水溶液、加热.