1.可逆反应A+3B?2C+2D(各物质均为气体)在不同条件下测得的下列4种反应速率,其中反应最快的是( )
0 167259 167267 167273 167277 167283 167285 167289 167295 167297 167303 167309 167313 167315 167319 167325 167327 167333 167337 167339 167343 167345 167349 167351 167353 167354 167355 167357 167358 167359 167361 167363 167367 167369 167373 167375 167379 167385 167387 167393 167397 167399 167403 167409 167415 167417 167423 167427 167429 167435 167439 167445 167453 203614
| A. | υD=0.4mol/(L•s) | B. | υC=0.5mol/(L•s) | C. | υB=0.6mol/(L•s) | D. | υA=0.22mol/(L•s) |

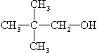 .
. 将等物质的量的Cl2和CH4混合气体A.
将等物质的量的Cl2和CH4混合气体A.