15.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+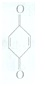 (对苯醌)═N2H4+
(对苯醌)═N2H4+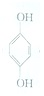 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为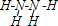 ,该电池正极的电极反应式为
,该电池正极的电极反应式为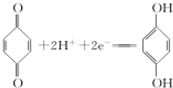 .
.
(2)25℃时.将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当混合溶液中,c(NH4+)=c(Cl-)时.则溶液的pH=7.
②当混合溶液中,c(NH4+)>c(Cl-)时.则反应的情况可能为a.
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K值和温度的关系如下:
①写出该反应的化学平衡常数的表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,b小于(填“大于”、“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”、“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为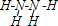 ,该电池正极的电极反应式为
,该电池正极的电极反应式为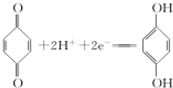 .
.(2)25℃时.将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当混合溶液中,c(NH4+)=c(Cl-)时.则溶液的pH=7.
②当混合溶液中,c(NH4+)>c(Cl-)时.则反应的情况可能为a.
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”、“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
14.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )


| A. | 外电路电子的移动方向:A→电源→B | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-═C6H12 |
13.化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
11.图表示汽车尾气净化处理过程,有关叙述正确的是( )
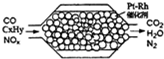

| A. | 上述过程中,NOX只被CO还原 | |
| B. | 安装该净化器的汽车使用含铅汽油不会造成污染 | |
| C. | 产生22.4L氮气(标准状况)时,转移4xmole- | |
| D. | Pt-Rh催化剂可提高尾气平衡转化率 |
10.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
9.利尿酸的结构简式如下图.下列有关利尿酸的说法不正确的是( )
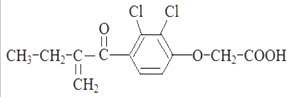

| A. | 分子式是C13H14O4Cl2 | |
| B. | 一定条件下能发生消去反应 | |
| C. | -定条件下能发生加聚反应 | |
| D. | 1mol利尿酸最多能与5molH2发生加成反应 |
8.除去下列物质中所含少量杂质的方法正确的是( )
| 物 质 | 杂 质 | 试剂 | 提 纯 方 法 | |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀NaOH溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 葡萄糖 | 浓(NH4)2SO4溶液 | 溶解、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
7.下列叙述正确的是( )
0 167212 167220 167226 167230 167236 167238 167242 167248 167250 167256 167262 167266 167268 167272 167278 167280 167286 167290 167292 167296 167298 167302 167304 167306 167307 167308 167310 167311 167312 167314 167316 167320 167322 167326 167328 167332 167338 167340 167346 167350 167352 167356 167362 167368 167370 167376 167380 167382 167388 167392 167398 167406 203614
| A. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| B. | 为了防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| C. | “碳纳米泡沫”倍称为第五形态的单质碳,它与石墨弧称为同位素 | |
| D. | 海水淡化能解决淡水供应危机,向海水中加入净水剂明矾可以使海水淡化 |

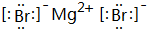
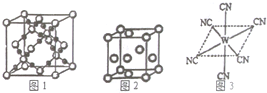 已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:
已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答: