4.据报道,1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子.现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
| A. | 第5周期第IA族 | B. | 第4周期第IA族 | C. | 第3周期第IA族 | D. | 第3周期第IA族 |
3.将甲、乙两种金属的性质相比较,能说明甲的金属性比乙强的是( )
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某非金属反应时甲原子失电子数目比乙的多
⑤以甲、乙金属为电极构成原电池,甲作负极.
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某非金属反应时甲原子失电子数目比乙的多
⑤以甲、乙金属为电极构成原电池,甲作负极.
| A. | ①④ | B. | ③⑤ | C. | ①②③④⑤ | D. | ①②③⑤ |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| C. | 标准状况下,11.2LSO3所含分子数为0.5NA | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
1.下列离子方程式正确的是( )
| A. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | CuSO4与Ba (OH)2溶液混合 Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
19. 已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )
 已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )| A. | a容器中,0~5min反应速率v(H2)=0.08mol•L-1•min-1 | |
| B. | 反应进行到5min时,b容器中v正=v速 | |
| C. | 其他条件不变时,减压可将b中的状态转变成c中的状态 | |
| D. | 达到平衡时a、b、c容器中的转化率为b>a>c |
18.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: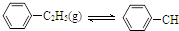 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
经一段时间后达到平衡.反应过程中测定的部分数据见下表:
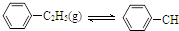 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )经一段时间后达到平衡.反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
17.SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径.请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
(3)甲醇汽油也是一种新能源清洁燃料.工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H=-90kJ•mol-1
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
则 c1= c2(填“>”或“<”或“=”),a=36.
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
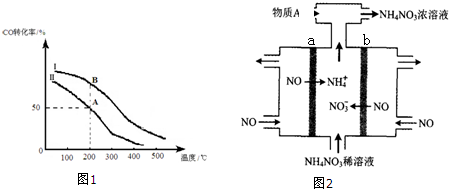
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.

16.已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:下列说法中,不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| C. | 容器①中CO反应速率等于H2O的反应速率 | |
| D. | 平衡时,两容器中CO2的浓度相等 |
15.N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)?4NO2(g)+O2(g)△H>0,T1温度下的部分实验数据为下列说法不正确的是( )
0 167185 167193 167199 167203 167209 167211 167215 167221 167223 167229 167235 167239 167241 167245 167251 167253 167259 167263 167265 167269 167271 167275 167277 167279 167280 167281 167283 167284 167285 167287 167289 167293 167295 167299 167301 167305 167311 167313 167319 167323 167325 167329 167335 167341 167343 167349 167353 167355 167361 167365 167371 167379 203614
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.