10.某元素原子最外层有两个电子,此元素( )
| A. | 是主族元素 | |
| B. | 是ⅡA族或ⅡB族元素 | |
| C. | 是金属元素 | |
| D. | 无负价,可能是金属元素,也可能不是金属元素 |
9.已知有关物质的熔、沸点数据如下:
请参考上述数据回答下列问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法产生铝.为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?答MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
| MgO | AlO3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法产生铝.为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?答MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
7.已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4.一般而言,该式中m大的是强酸,m小的是弱酸.下列各含氧酸中酸性最强的是( )
| A. | H2SeO3 | B. | HMnO4 | C. | H3BO3 | D. | H3PO4 |
4.下列说法中正确的是( )
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 具有固定熔点或沸点的物质一定是纯净物 | |
| C. | 一种离子和一种分子的质子数和电子数不可能同时相等 | |
| D. | 共价化合物溶于水电离过程中,共价键被破坏 |
3.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子存在非极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
2.下列说法中正确的是( )
| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 | |
| D. | 单质的晶体中一定不存在的微粒是阴离子 |
1.关于1mol•L-1的硫酸溶液的下列叙述中,不正确的是( )
0 167139 167147 167153 167157 167163 167165 167169 167175 167177 167183 167189 167193 167195 167199 167205 167207 167213 167217 167219 167223 167225 167229 167231 167233 167234 167235 167237 167238 167239 167241 167243 167247 167249 167253 167255 167259 167265 167267 167273 167277 167279 167283 167289 167295 167297 167303 167307 167309 167315 167319 167325 167333 203614
| A. | 1L该溶液中含溶质98g | |
| B. | 从10mL 该溶液中取出5mL后,剩余溶液的浓度为0.5mol•L-1 | |
| C. | 将4.9g浓硫酸加入盛有50mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性,但不具有强氧化性 |
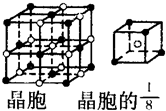 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水. ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心.该化合物的电子式是
”表示)均位于小正方体中心.该化合物的电子式是 .
.